Isomería
| Isomería | |
|---|---|
| propiedá y rellación | |
La isomería ye una propiedá d'aquellos compuestos químicos n'especial les cadenes de carbonu, que, con igual fórmula molecular (fórmula química non desenvuelta) d'iguales proporciones relatives de los átomos que conformen la so molécula, presenten estructures químiques distintes, y poro, distintes propiedaes y configuración. Dichos compuestos reciben la denominación de isómeros. Por casu, el alcohol etílico o etanol y el éter dimetílico son isómeros que la so fórmula molecular ye C2H6O.
Ello ye que una de les primeres coses qu'un químicu hai de faer cuando quier resolver la estructura completa d'una nueva especie molecular ye establecer los elementos químicos que formen parte de la so composición y tamién la proporción relativa na que s'atopen los mesmos.[1]
Dempués, tendrá de resolver el pesu molecular de la nueva sustancia químico y de toos estos datos calcular la fórmula molecular, esto ye, el númberu d'átomos de cada elementu que s'atopen presentes na molécula.[2]
Llegáu a esti puntu tendrá de centrase les investigaciones en determinar la manera na que los átomos tán coneutaos ente sigo na molécula so estudiu y cómo estos átomos ordenar nel espaciu, momentu nel cual entra en xuegu la isomería, yá que polo xeneral van abrise numberoses posibilidaes de sustancies cola mesma fórmula molecular, toes elles conócense pol nome xenéricu de isómeros.[3]
Anque esti fenómenu ye bien frecuente en Química orgánica, nun ye esclusiva d'ésta pos tamién la presenten dalgunos compuestos inorgánicos, como los compuestos de los metales de transición.
Historia[editar | editar la fonte]
El isomerismo foi reparáu per primer vegada en 1827, cuando Friedrich Woehler preparó cianato de plata (AgOCN) y notó que, a pesar de que la so composición elemental yera idéntica a la del fulminato de plata (preparáu por Justus von Liebig l'añu anterior),[4] les sos propiedaes yeren bien distintes. Esti afayu desafiaba la comprensión química predominante de la dómina, que sostenía que los compuestos químicos podíen ser distintos namái cuando teníen distintes composiciones elementales. Dempués de más descubrimientos del mesmu tipu, como'l descubrimientu de 1828 de Woehler de que la urea tenía la mesma composición atómica que'l químicamente distintu cianato de amonio, Jöns Jakob Berzelius introdució'l términu isomerismo en 1830 pa describir esti fenómenu.[5]
En 1848, Louis Pasteur dixebró diminutos cristales d'acedu tartárico nos sos dos formes especulares.[6][7] Les molécules individuales de cada unu yeren los estereoisómeros ópticos d'esquierda y derecha, que les sos soluciones faíen xirar el planu de lluz polarizao nun mesmu grau, pero en direiciones opuestes.
Isomería en química orgánica[editar | editar la fonte]
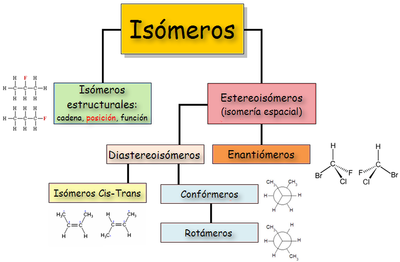
Esisten dos tipos básicos de isomería: estructural y espacial.[8]
Isomería constitucional o estructural[editar | editar la fonte]
Ye una forma de isomería, onde les molécules cola mesma fórmula molecular tienen una distinta distribución de los enllaces ente los sos átomos, al contrariu de lo qu'asocede na estereoisomería.
Por cuenta de esto puédense presentar trés distintos maneres de isomería:
- Isomería de cadena o cadarma.- Los isómeros d'esti tipu tienen componentes de la cadena afechos en distintos llugares, ye dicir les cadenes carbonadas son distintes, presenten distinta cadarma o estructura.
Un exemplu ye'l pentano, del cual esisten dellos isómeros, pero los más conocíos son el isopentano y el neopentano.
- Isomería de posición.- Ye la d'aquellos compuestos nos que los sos grupos funcionales tán xuníos en distintes posiciones.
Un exemplu simple d'esti tipu de isomería ye la del pentanol, onde esisten trés isómeros de posición: 1-pentanol, 2-pentanol y 3-pentanol.
- Isomería de grupu funcional.- Equí, la distinta conectividad de los átomos, puede xenerar distintos grupos funcionales na cadena. Un exemplu ye'l ciclohexano y el 1-hexeno, que tienen la mesma fórmula molecular (C6H12), pero'l ciclohexano ye un alcano cíclicu o cicloalcano y el 1-hexeno ye un alqueno.
Hai dellos exemplos de isomería como la d'ionización, coordinación, enllaz, xeometría y óptica.
Isomería de cadena o ordenación[editar | editar la fonte]
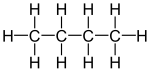
Varia la disposición de los átomos de carbonu na cadena o cadarma carbonado, ye dicir la estructura d'ésti, que puede aportar a llinial o bien tener distintes ramificaciones depende de la so llongura.
Por casu el C4H10 correspuende tanto al butanu como al metilpropano (isobutano o terc-butanu):
|

|
|---|---|
|
Metilpropano |
Pa la fórmula C5H12, tenemos trés posibles isómeros de cadena: pentano, metilbutano (isopentano) y dimetilpropano (neopentano). El númberu de isómeros de cadena crez rápido al aumentar el númberu d'átomos de carbonu.
==== Isomería de posición Presentar aquellos compuestos que tienen el mesmu cadarma carbonado pero nos que'l grupu funcional ocupa distinta posición.
Por casu, la fórmula molecular C4H10O puede corresponder a dos sustancies isómeras que s'estremen na posición del grupu OH: el 1-butanol y el 2-butanol.
| CH3-CH2-CH2-CH2OH | CH3-CH2-CHOH-CH3 |
|---|---|
| 1-butanol, Butan-1-ol o n-butanol | 2-butanol, Butan-2-ol o sec-butanol |
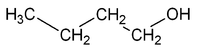
|

|
Esti tipu de isomería resulta de la posibilidá d'asitiar grupos funcionales, cadenes llaterales en posiciones estructuralmente non equivalentes. Supongamos que sustituyimos unu de los átomos d'hidróxenu del butanu, CH3-CH2-CH2-CH3, por un grupu hidroxilo. Numberando los carbonos de la cadena del butanu y realizando esta sustitución nel carbonu estremo (C1), llogramos un alcohol llamao butan-1-ol (1-butanol). Si sustituyimos un hidróxenu del C2 pol grupu -OH, llogramos l'alcohol isómero butan-2-ol (2-butanol), que difier na posición del grupu hidroxilo. Reparar que, sicasí, si realizamos la sustitución nel C3, nun llogramos un tercer isómero, sinón de nuevu'l 2-butanol. Los dos representaciones que s'indiquen pal 2-butanol son estructuralmente idéntiques, como puede vese xirando la so estructura 180° alredor d'una exa.
Isomería de compensación o por compensación[editar | editar la fonte]
Dacuando llámase isomería de compensación o metamería la d'aquellos compuestos nos cualos una función corta la cadena carbonada en porciones de llargores distintos.[9]
Por casu dos metámeros de fórmula molecular C4O2H8 son:
| HCOO-CH2-CH2-CH3 | CH3-COO-CH2-CH3 |
|---|---|
| Metanoato de propilo | Etanoato de etilo |
Esti tipu de isomería yera más usáu nel pasáu que na actualidá. Aplicábase inclusive a aldehídos-cetonas,[10] a los que güei se suelen considerar isómeros de función.
Isomería funcional[editar | editar la fonte]
Varia'l grupu funcional, calteniendo la cadarma carbonado.
Por casu el C3H6O puede corresponder a la molécula de propanal (función aldehído) o a la propanona (función cetona).
| CH3-CH2-CHO | CH3-CO-CH3. |
|---|
....
| Propanal (función aldehído) | Propanona (función cetona) |}
Esta isomería presentar ciertos grupos de compuestos rellacionaos como: los alcoholes y éteres, los ácidos y ésteres, y tamién los aldehídos y cetonas.
Tautomería[editar | editar la fonte]
Ye un tipu especial de isomería na qu'esiste transposición d'un átomu ente los dos estructures, xeneralmente hidróxenu, esistiendo amás un fácil equilibriu ente dambes formes tautómeras.[11]
Un exemplu de la mesma ye la tautomería ceto-enólica na qu'esiste equilibriu ente un compuestu con grupu OH xuníu a unu de los átomos de carbonu d'un doble enllace C=C, y un compuestu col grupu carbonilo entemediu, C=O típicu de les cetonas, con transposición d'un átomu d'hidróxenu.

|
|---|
| Tautomería ceto-enólica. |
Isomería espacial o estereoisomería[editar | editar la fonte]
Presenten estereoisomería aquellos compuestos que tienen fórmules moleculares idéntiques y los sos átomos presenten la mesma distribución (la mesma forma de la cadena; los mesmos grupos funcionales y sustituyentes; asitiaos na mesma posición), pero la so disposición nel espaciu ye distinta, esto ye, difieren na orientación espacial de los sos átomos.
Los estereoisómeros tienen igual forma si representar nun planu. Ye necesariu representalos nel espaciu pa visualizar les diferencies. Pueden ser de dos tipos: isomería conformacional y isomería configuracional, según que los isómeros puedan convertise unu n'otru por simple rotación d'enllaces simples o non.
Otra clasificación estremar en enantiómeros y diastereoisómeros. Ente los diastereoisómeros atópense los isómeros cis-trans (antes conocíu como isómeros xeométricos), los confórmeros o isómeros conformacionales y, nes molécules con dellos centros quirales, los isómeros que pertenecen a distintes pareyes de enantiómeros.
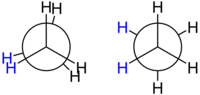
Isomería conformacional[editar | editar la fonte]
Esti tipu de isómeros conformacionales[12] o confórmeros, la conversión d'una forma n'otra ye posible pos la rotación en redol a la exa del enllaz formáu polos átomos de carbonu ye más o menos llibre (ver animación a la derecha). Por eso tamién reciben el nome de rotámeros.
Los isómeros conformacionales xeneralmente nun son xebrables o aislables, por cuenta de la facilidá de interconversión entá a temperatures relativamente baxes. La caña de la estereoquímica qu'estudia los isómeros conformacionales que sí son aislables (la mayoría son derivaos del bifenilo) llámase atropisomería.
Estes formes reconócense bien si utiliza la proyeición de Newman, como s'aprecia nos dibuxos de la esquierda. Reciben nomes como sinclinal (dacuando, gauche), anticlinal (anti o trans), sinperiplanar y antiperiplanar.[12]
Otru tipu de isómeros conformacionales dar en compuestos con aniellos hexagonales como'l ciclohexano, onde son facederos la conformanza en forma de siella y conformanza en forma de bote.
Isomería configuracional[editar | editar la fonte]
Nun basta una simple rotación pa convertir una forma n'otra y anque la disposición espacial sía la mesma, los isómeros nun son interconvertibles. Estremar en: isomería xeométrica o cis-trans, y isomería óptica. Los isómeros configuracionales son aislables, yá que ye necesaria una gran cantidá d'enerxía pa interconvertirlos (ríquese enerxía necesaria pa la rotura d'enllaces),
Isomería xeométrica o cis-trans[editar | editar la fonte]
La isometría cis-trans ye un tipu d'estereoisomería, que refierse a los compuestos que tienen los sos átomos coneutaos nel mesmu orde pero tienen distinta orientación tridimensional. Esti tipu de isomería presenta en cicloalcanos (serie de carbonos que conformen un aniellu) y en alquenos (cadena de carbonos xuníos por una doble lligadura). Produzse cuando esisten dos grupos idénticos pa comparar y atópense en distintes posiciones.[13][14]
Nel casu de los cicloalcanos nómase cis cuando los grupos funcionales atopar del mesmu llau del aniellu y trans si s'atopa en llaos contrarios. De la forma que puede reparase na imaxe.[14]

Nel casu de los dobles enllaces, emplégase cis si los grupos atopar del mesmu llau del doble enllaz y trans si los grupu atópase en llaos opuestos. Podemos reparar los dos casos nes siguientes imáxenes.[14]


Esti tipu de isomería da propiedaes físiques distintes, por cuenta de que los enllaces dobles non rotan llibremente como los simples.[14]
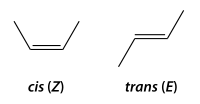
Produzse cuando hai dos carbonos xuníos con doble enllaz que tienen les otres valencies colos mesmos sustituyentes (2 pares) o con dos iguales y unu distintu.
Nun se presenta isomería xeométrica amestada a los enllaces triples o senciellos.
A los dos posibilidaes denominar:
- forma cis (o forma Z), colos dos sustituyentes más avolumaos del mesmu llau, y *
forma trans (o forma Y), colos dos sustituyentes más avolumaos en posiciones opuestes. Nun se pueden interconvertir ente sigo estos dos formes d'una manera bonal, pos el doble enllaz torga la rotación, anque sí pueden convertise, dacuando, en reacciones catalizadas.
| Isómeros del But-2-eno | Acedu maleico (Cis) y acedu fumárico (trans) |
Formes trans (Y) y cis (Z) del 1,2-dibromoeteno. |
|---|---|---|

|
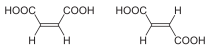
|

|
La isomería xeométrica tamién se presenta en compuestos con doble enllaz N=N, o en compuestos cíclicos nos que tamién se torgar la rotación en redol a una exa.
| 1,2-dimetilciclopentano (formes cis y trans) |
cis-1,2-diclorociclohexano | trans-1,2-diclorociclohexano | Formes cis y trans del difluorodiazeno |
|---|---|---|---|

|

|

|

|
Isomería óptica o enantiomería[editar | editar la fonte]

Cuando un compuestu tien siquier un átomu de Carbonu asimétrico o quiral, esto ye, un átomu de carbonu con cuatro sustituyentes distintos, pueden formase dos variedaes distintes llamaes estereoisómeros ópticos, enantiómeros, formes enantiomórficas o formes quirales, anque tolos átomos tán na mesma posición y enllazaos d'igual manera. Esto conozse como Regla de -y Bel-van't Hoff.[8]
Los isómeros ópticos nun se pueden superponer, como asocede coles manes derecha y esquierda. Presenten les mesmes propiedaes físiques y químiques pero estremar en qu'esvien el planu de vibración de la lluz polarizao en distinta direición:
- un isómero esvia la lluz polarizao escontra la derecha (n'orientación coles manecillas del reló) y represéntase col signu (+): ye'l isómero dextrógiro o forma dextro;
- l'otru isómero ópticu esviar escontra la izquierda (n'orientación contraria coles manecillas del reló) y represéntase col signu (-)(isómero levógiro o forma levo).[15]
Otra forma de nomar estos compuestos ye por aciu el conveniu o nomenclatura D-L, de normal emplegando la proyeición de Fischer. Esta nomenclatura ye absoluta pero non necesariamente la forma (D) coincide col isómero dextrógiro o forma (+).[16]

Si una molécula tien n átomos de Carbonu asimétricos, va tener un total de 2n isómeros ópticos.
Tamién pueden representase estos isómeros coles lletres (R) y (S). Esta nomenclatura R-S, que sigue les regles de Cahn-Ingold-Prelog, tamién s'utiliza pa determinar la configuración absoluta de los carbonos quirales.
Con éses hai tres sistemes de nomar estos compuestos:
- según la direición d'esviación del planu de la lluz polarizao, estremamos les formes dextro (+) y levo (-);
- según la nomenclatura D-L (Formes D y L), que ye inequívoca pa isómeros con un solu carbonu asimétrico,[17] y *
según la configuración absoluta R-S (formes R y S),[18] más fayadiza pa molécules con dellos centros asimétricos.
Diasteroisómeros[editar | editar la fonte]
Cuando un compuestu tien más d'un carbonu asimétrico, podemos atopar formes enantiómeras y otres formes que nun son esautamente copies especulares, por non tener tolos sos carbonos invertíos. A estes formes llámase-yos diasteroisómeros. Por casu, el 3-bromu-butan-2-ol tien dos carbonos asimétricos polo que tien 4 formes posibles. D'elles, dalgunes son enantiomorfas, como (2S,3S)-3-bromu-butan-2-ol y (2R,3R)-3-bromu-butan-2-ol. Sicasí, (2R,3S)-3-bromu-butan-2-ol ye un diastereoisómero de los dos anteriores.
Amiestu racémica y formes meso[editar | editar la fonte]

Una amiestu racémica ye l'amiestu equimolecular de los isómeros dextro y levo. Esta fórmula ye ópticamente inactiva (nun esvia'l planu de la lluz polarizao). L'amiestu d'ácidu D-láctico y L-láctico forma un amiestu racémica, ópticamente inactiva.
Si un compuestu tien dos carbonos asimétricos, puede tener unu dextrógiro y otru levógiro, pero si tien un planu de simetría, en xunto pórtase como ópticamente inactivu y recibe el nome de forma meso. Ye'l casu del acedu tartárico o 2,3-dihidroxibutanodioico, unu de que los sos isómeros ye una forma meso.
Poder rotatoriu específicu[editar | editar la fonte]
Ye la esviación que sufre'l planu de polarización al travesar la lluz polarizao una disolución con una concentración de 1 gramu de sustancia por cm³ nun recipiente de 1 dm d'altor. Ye'l mesmu pa dambos enantiómeros, anque de signu contrariu. Midir col polarímetro.[19]
Isomería en química inorgánica[editar | editar la fonte]
Hai dellos tipos de isomería presente en compuestos inorgánicos, sobremanera en complexos de coordinación,[20] pero esti fenómenu nun ye tan importante como en química orgánica:
- Isomería estructural o topolóxica: Los átomos xunir de manera distinta, como nel S2F2, de los qu'esiste una molécula en forma de cadena y otra en forma de pirámide triangular. Un casu especial ye la tautomería, na qu'un átomu de H camuda de posición.
- Isomería conformacional: Igual a la yá comentada pa compuestos orgánicos. Presentar en compuestos con enllaz senciellu como P2H4 o'l ion ditionito, S2O42-, onde esisten formes clisaes, gradiaes y sinclinal (gauche).
- Isomería cis-trans (xeométrica): Apaez en compuestos como'l acedu nitroso, HNO2, o en complexos de coordinación planu-cuadraos como [PtCl2(NH3)2].
- Isomería de posición, como en dalgunos heterociclos d'azufre y nitróxenu. Nel S6(NH)2 caltiénse l'aniellu octogonal del azufre pero dos átomos d'azufre fueron sustituyíos por grupos NH,que pueden tar en posición 1,2; 1,3; 1,4 y 1,5.
- Isomería óptica: tamién apaez en compuestos de coordinación d'estructura tetraédrica con sustituyentes distintes.
- Isomería d'ionización: Intercámbiense un amestando del catión con unu de los aniones que lo neutralicen,como asocede ente [CrSO4(NH3)5]Cl y [CrCl(NH3)5]SO4
- Isomería de coordinación: Si ambos iones son complexos, podemos intercambiar los sos ligandos y vamos llograr isómeros distintos, como asocede ente [Co(NH3)6][Cr(CN)6] [Cr(NH3)6][Co(CN)6].

Isomería d'enllaz nun complexu de cobaltu. - Isomería d'enllaz: Dellos ligandos pueden xunise de manera distinta al ion central,como asocede en [CoCl(NON2)(NH3)4]+ [CoCl(ONO)(NH3)4]+[21]
- Isomería de polimerización: Ye'l casu de NON2 y N2O4, dos óxidos de nitróxenu gaseosos.
Referencies[editar | editar la fonte]
- ↑ «Isomería Molecular». Consultáu'l 8 de xineru de 2016.
- ↑ «Lleición 5. FÓRMULA MOLECULAR | Quiral». Consultáu'l 8 de xineru de 2016.
- ↑ «Lleición 6. Isomería Constitucional | Quiral». Consultáu'l 8 de xineru de 2016.
- ↑ F. Kurzer (2000). «Fulminic Acid in the History of Organic Chemistry». J. Chem. Educ. 77 (7): páxs. 851–857. doi:. Bibcode: 2000JChEd..77..851K. http://jchemed.chem.wisc.edu/journal/Issues/2000/Jul/abs851.html.
- ↑ Esteban, Soledad. (2008). «Liebig–Wöhler Controversy and the Concept of Isomerism». J. Chem. Educ. 85 (9): p. 1201. doi:. Bibcode: 2008JChEd..85.1201Y. http://jchemed.chem.wisc.edu/Journal/Issues/2008/Sep/abs1201.html.
- ↑ L. Pasteur (1848) "Mémoire sur la relation qui peut exister ente formar cristalline et la composition chimique, et sur causar de la polarisation rotatoire" (Memoir on the relationship which can exist between crystalline form and chemical composition, and on the cause of rotary polarization)," Comptes rendus de l'Académie des sciences (Paris), vol. 26, pages 535–538.
- ↑ L. Pasteur (1848) "Sur les relations qui peuvent exister ente formar cristalline, la composition chimique et le sens de la polarisation rotatoire" (On the relations that can exist between crystalline form, and chemical composition, and the sense of rotary polarization), Annales de Chimie et de Physique, 3rd series, vol. 24, non. 6, pages 442–459.
- ↑ 8,0 8,1 Química: Teoría y problemes. José Antonio García Pérez y otros. Ed. Tébar Flores. Albacete, 1996. ISBN 8473601559.Páx. 253 y ss.
- ↑ Química xeneral. M. Garric. Editorial Reverté, 1979. ISBN 8429171770. Páx. 170
- ↑ Cursu de química biolóxica. Venancio Deulofeu, Agustín Domingo Marenzi. Editorial L'Atenéu, 1946. Páx. 34
- ↑ Química orgánica. Robert Thornton Morrison, Robert Neilson Boyd. 5ª ed., Editorial Pearson Educación, 1998. ISBN 9684443404. Páx. 421
- ↑ 12,0 12,1 Título Fundamento de química orgánica. Carl David Gutsche. Editorial Reverté, 1979. ISBN 8429174753. Páx.67
- ↑ McMurry, John (2008) Química Orgánica. Méxicu: Cengage Learning.
- ↑ 14,0 14,1 14,2 14,3 Klein, David (2014) Química Orgánica. España: Editoral Médica Panamericana.
- ↑ Química xeneral; 8ª edición; Petrucci, Harwood y Herring; Prentice Hall; ISBN 0-13-014329-4
- ↑ https://books.google.es/books?id=VmdvQfFbq9UC&pg=PA166 Configuración absoluta. En: Diccionariu de química. Inmaculada Julián. Editorial Complutense, 1999. ISBN 8489784728. Páx. 166
- ↑ Nomenclatura D-L. En: Cursu de biomoléculas. Juan Manuel González Mañas. Universidá del País Vascu.
- ↑ Configuración absoluta de los centros quirales: cómo determinala y designala. En: Química orgánica. Stephen J Weininger, Frank R. Stermitz. Editorial Reverté, 1988. ISBN 842917527X. Páx. 132
- ↑ Química orgánica básica y aplicada: de la molécula a la industria, Volume 1. Eduardo Primu Yúfera. Editorial Reverté, 1996. ISBN 8429179534, Páx. 52 y ss.
- ↑ Química inorgánica estructural. A.F. Wells. Editorial Reverté, 1978. ISBN 8429175245. Páx. 48 y ss.
- ↑ http://www.textoscientificos.com/quimica/inorganica/metales-transicion/isomeria Isomería en TextosCientíficos.com
Enllaces esternos[editar | editar la fonte]
- Isomería Páxina en Averroes
- Isomería:tipos. Universidá d'Huelva