Alquín


Los alquinos son hidrocarburos alifáticos con siquier un triple enllaz (dos enllaces π pi y unu Σ sigma) -C≡C- ente dos átomos de carbonu. Trátase de compuestos metaestables por cuenta de la alta enerxía del triple enllace carbonu-carbonu. La so fórmula xeneral ye CnH2n-2.
Nomenclatura
[editar | editar la fonte]Por que dean nome a los hidrocarburos del tipu alquino síguense ciertes regles similares a les de los alquenos.
- Tómase como cadena principal la cadena continua más llarga que contenga l'o los triples enllaces.
- La cadena numbérase de forma que los átomos del carbonu del triple enllaz tengan los númberos más baxos posibles.
- Dicha cadena principal a unu de los átomos de carbonu del enllaz triple. Dichu númberu asítiase antes de la terminación -ino. Ej.: CH3-CH2-CH2-CH2-C≡C-CH3, hept-2-ino.
- Si hai dellos triples enllaces, indicar colos prefixos di, tri, tetra... Ej.: octa-1,3,5,7-tetraino, CH≡C-C≡C-C≡C-C≡CH.
- Si esisten dobles y triples enllaces, dase'l númberu más baxu al doble enllaz. Ej.: pent-2-en-4-ino, CH3-CH=CH-C≡CH
- Los sustituyentes tales como átomos d'halóxenu o grupos arriendo indicar por aciu el so nome y un númberu, de la mesma forma que pal casu de los alcanos. Ej.: 3-cloropropino, CH≡C-CH2Cl; 2,5-dimetilhex-3-ino, CH3-CH(CH3)-C≡C-CH(CH3)-CH3.
NOMENCLATURA DE ALQUINOS
CHCH etino(acetilenu) CH3–CCH solmeno CH3–CH2–CCH 1-butino CH3-CC-CH3 2-butino CHC- etinilo CHC-CH2– 2-propinilo CH3–CC- 1-propinilo CH3–CH2–CH2–CCH 1-pentino
Propiedaes físiques
[editar | editar la fonte]1) Son insolubles n'agua, pero bastante solubles en disolventes orgánicos avezaos y de baxa polaridá: ligroína, éter, bencenu, tetracloruro de carbonu.
2) Son menos trupos que l'agua y los sos puntos de ebullición amuesen l'aumentu avezáu cola medría del númberu de carbonos y l'efectu habitual de ramificación de les cadenes.
3) Los puntos de ebullición son cuasi los mesmos que pa los alcanos o alquenos col mesmu cadarma carbonado.
4) Los trés primeros términos son gases; los demás son líquidos o sólidos.
5)A midida qu'aumenta'l pesu molecular aumenten la densidá, el puntu de fusión y el puntu de bullidura.
6) Los acetilenos son compuestos de baxa polaridá, polo cual les sos propiedaes físiques son bien asemeyaes a la de los alquenos y alcanos.
Hai que tener en cuenta que los acetilenos completen la regla del cuartetu.
Propiedaes químiques
[editar | editar la fonte]Les reacciones más frecuentes son les d'adición: d'hidróxenu, halóxenu, agua, etc. Nestes reacción ruempe'l triple enllaz y fórmense enllaces de menor polaridá: dobles o senciellos.

Hidrogenación de alquinos
[editar | editar la fonte]Los alquinos pueden ser hidrogenados pa dar los correspondientes cis-alquenos (doble enllaz) tratándolos con hidróxenu en presencia d'un catalizador de paladiu sobre sulfatu de bariu o sobre carbonatu de calciu (catalizador Lindlar) parcialmente envelenáu con óxidu de plomu. Si utilízase paladiu sobre carbón activo el productu llográu suel ser el alcano correspondiente (enllaz senciellu).
- CH≡CH + H2 → CH2=CH2 + H2 → CH3-CH3
Anque la densidá d'electrones y con esto de carga negativa nel triple enllaz ye alzada pueden ser atacaos por nucleófilos. La razón atópase na relativa estabilidá del anión de vinilu formáu.
Frente al sodiu o'l litiu en amoniacu líquidu, se hidrogena produciendo trans-alquenos.[1]
- CH3-C≡C-CH3 + 2 Na + 2 NH3 → CH3-CH=CH-CH3 (trans) + 2 NaNHH2
Halogenación, hidrohalogenación ya hidratación de alquinos
[editar | editar la fonte]Según asocéde-yos a los alquenos, los alquinos participen n'otres reacciones de adición:
Dependiendo de les condiciones y de la cantidá añadida d'halóxenu (flúor, F2; cloru, Cl2; bromu, Br2...), puede llograse derivaos haloxenaos del alqueno o del alcano correspondiente.
- HC≡CH + Br2 → HCBr=CHBr
- HC≡CH + 2 Br2 → HCBr2-CHBr2
Hidrohalogenación, hidratación, etc.
[editar | editar la fonte]El triple enllaz tamién puede amestar halogenuros d'hidróxenu, agua, alcohol, etc., con formación d'enllaces dobles o senciellos. Polo xeneral síguese la regla de Markovnikov.
- HC≡CH + H-X → CH2=CHX onde X = F, Cl, Br...
- HC≡CH + H2O → CHOH=CH2
Acidez del hidróxenu terminal
[editar | editar la fonte]En delles reacciones (frente a bases fuertes, como amiduro de sodiu Na-NH2 n'amoniacu NH3) actúen como ácidos débiles pos l'hidróxenu terminal presenta cierta acidez. Fórmense acetiluros (base conxugada del alquino)que son bonos nucleófilos y dan mecanismos de sustitución nucleófila colos reactivos fayadizos.[2] Esto dexa llograr otros alquinos de cadena más llarga.
- HC≡CH + Na-NH2 → HC≡C:- Na+
- HC≡C:- Na+ + Br-CH3 → HC≡C-CH3 + NaBr
Nesti casu'l acetiluro de sodiu formáu reaccionó con bromometano con formación de solmeno.
Reacciones pericíclicas
[editar | editar la fonte]Aplicaciones
[editar | editar la fonte]La mayor parte de los alquinos fabricar en forma d'acetilenu. De la mesma, una bona parte del acetilenu utilízase como combustible na soldadura a gas por cuenta de les elevaes temperatures alcanzaes.
Na industria químico los alquinos son importantes productos de partida por casu na síntesis del PVC (adición de HCl) de cauchu artificial etc.
El grupu alquino ta presente en dellos fármacos citostáticos.
Los polímeros xeneraos a partir de los alquinos, los polialquinos, son semiconductores orgánicos y pueden ser dotaos paecíu al siliciu anque se trata de materiales flexibles y llongures.
Analís
[editar | editar la fonte]Los alquinos decolorean una solución aceda de permanganato de potasiu y l'agua de bromu. Si tratar de alquinos terminales (col triple enllaz a unu de los carbonos finales de la molécula) formen sales con soluciones amoniacales de plata o de cobre (estos sales son esplosives).
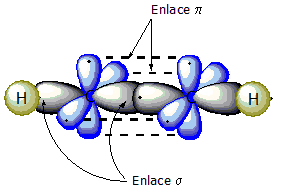
Estructura electrónica
[editar | editar la fonte]El triple enllaz ente los carbonos ye formáu por dos orbitales sp y dos orbitales p. Los enllaces escontra'l restu de la molécula realícense al traviés de los orbitales sp restantes. La distancia ente los dos átomos de carbonu ye típicamente de 120 pm. La xeometría de los carbonos del triple enllaz y los sos sustituyentes ye llinial.
Ver tamién
[editar | editar la fonte]Referencies
[editar | editar la fonte]- ↑ Hidrogenación de Alquinos con Sodiu n'Amoniacu Líquidu. Quimicaorganica.org
- ↑ aciu-alquilacion.html Síntesis de Alquinos por aciu Alquilación. Quimicaorganica.org
Enllaces esternos
[editar | editar la fonte]- Alquinos
- Nomenclatura de alquinos. (enllaz rotu disponible n'Internet Archive; ver l'historial y la última versión). Academia Mines.