Glucólisis
| Glucólisis | |
|---|---|
| procesu biolóxicu | |
|
ATP generation from ADP (en) | |
 | |
| Reacción global de la glucólisis[1] |
|---|
  + + 
|
| α-D-glucosa + 2NAD+ + 2ADP + 2Pi ==> 2(piruvato) + 2NADH + 2ATP + 2H+ + 2H2O |
La glucólisis o glicólisis (del griegu glycos, azucre y lysis, rotura), ye la vía metabólica encargada d'aferruñar la glucosa cola cuenta de llograr enerxía pa la célula. Consiste en 10 reacciones enzimáticas consecutives que converten a la glucosa en dos molécules de piruvato, que ye capaz de siguir otres víes metabóliques y asina siguir apurriendo enerxía al organismu.[1]
El tipu de glucólisis más común y más conocida ye la vía de Embden-Meyerhof, esplicada primeramente por Gustav Embden y Otto Fritz Meyerhof. El términu puede incluyir víes alternatives, como la ruta de Entner-Doudoroff. Sicasí, glucólisis usar con frecuencia como sinónimu de la vía de Embden-Meyerhof. Se continua col ciclu de Krebs. Ye la vía inicial del catabolismo (degradación) de carbohidratos.
Descubrimientu[editar | editar la fonte]
Los primeros estudios informales de los procesos glucolíticos fueron empecipiaos en 1860, cuando Louis Pasteur afayó que los microorganismos son los responsables de la fermentadura,[2] y en 1897 cuando Eduard Buchner atopó que ciertu estractu celular puede causar fermentadura. La siguiente gran contribución foi d'Arthur Harden y William Young en 1905, quien determinaron que por que la fermentadura tenga llugar son necesaries una fracción celular de masa molecular elevada y termosensible (enzimes) y una fracción citoplasmática de baxa masa molecular y termorresistente (ATP, ADP, NAD+ y otres coenzimes). Los detalles de la vía en sí determináronse en 1940, con una gran meyora de Otto Meyerhoff y dellos años dempués por Luis Leloir. Les mayores dificultaes en determinar lo entrevesgao de la vía fueron la curtia vida y les baxes concentraciones de los intermediarios nes rápides reacciones glicolíticas.
En eucariotes y procariotas, la glucólisis asocede nel citosol de la célula. En célules vexetales, dalgunes de les reacciones glucolíticas atópense tamién nel ciclu de Calvin, qu'asocede dientro de los cloroplastos. L'ampliu caltenimientu d'esta vía inclúi los organismos filoxenéticamente más antiguos, y por esto considérase una de les víes metabóliques más antigües.[3]
Visión xeneral[editar | editar la fonte]

Mientres la glucólisis llógrase un rendimientu netu de dos molécules d'ATP ; el ATP puede ser usáu como fonte d'enerxía pa realizar trabayu metabólicu, ente que'l NADH puede tener distintos destinos. Puede usase como fonte de poder reductor en reacciones anabólicas; si hai osíxenu, puede aferruñase na cadena respiratoria, llográndose 5 ATP (2.5 por cada NADH); si nun hai dioxígeno, usar p'amenorgar el piruvato a lactato (fermentadura láctica), o a CO2 y etanol (fermentadura alcohólica), ensin llogru adicional d'enerxía.
La glucólisis ye la forma más rápida de consiguir enerxía pa una célula y, nel metabolismu de carbohidratos, xeneralmente ye la primer vía a la cual recúrrese. Atópase estructurada en 10 reacciones enzimáticas que dexen el tresformamientu d'una molécula de glucosa a dos molécules de piruvato por aciu un procesu catabólico.
La glucólisis ye una de les víes más estudiaes, y xeneralmente atópase estremada en dos fases: la primera, de gastu d'enerxía y la segunda fase, de llogru d'enerxía.
La primer fase consiste en tresformar una molécula de glucosa en dos molécules de gliceraldehído (una molécula de baxa enerxía) por aciu l'usu de 2 ATP. Esto dexa doblar los resultaos de la segunda fase de llogru enerxéticu.
Na segunda fase, el gliceraldehído tresformar nun compuestu d'alta enerxía, que la so hidrólisis xenera una molécula de ATP, y como se xeneraron 2 molécules de gliceraldehído, llograr en realidad dos molécules de ATP. Esti llogru d'enerxía llograr por aciu l'acoplamientu d'una reacción fuertemente exergónica dempués d'una llevemente endergónica. Esti acoplamientu asocede una vegada más nesta fase, xenerando dos molécules de piruvato. D'esta manera, na segunda fase llógrense 4 molécules de ATP.
Reacciones posteriores[editar | editar la fonte]
Depués de qu'una molécula de glucosa tresformar en 2 molécules de piruvato, les condiciones del mediu en que s'atope van determinar la vía metabólica a siguir.
N'organismos aeróbicos, el piruvato va siguir aferruñándose pola enzima piruvato deshidrogenasa y el ciclu de Krebs, creando intermediarios como NADH y FADH2. Estos intermediarios nun pueden cruciar la membrana mitocondrial, y poro, utilicen sistemes d'intercambiu con otros compuestos llamaos danzaderes (n'inglés, shuttles). Los más conocíos son la danzadera malato-aspartato y la danzadera glicerol-3-fosfatu. Los intermediarios llogren apurrir los sos equivalentes[4] al interior de la membrana mitocondrial, y que depués van pasar pola cadena de tresporte d'electrones, que los usará pa sintetizar ATP.
D'esta manera, puede llograse hasta 30 moles d'ATP a partir de 1 mol de glucosa como ganancia neta.
Sicasí, cuando les célules nun tener mitocondrias (ex: eritrocitu) o cuando rican de grandes cantidaes d'ATP (ej.: el músculu al exercitase), el piruvato sufre fermentadura que dexa llograr 2 moles d'ATP por cada mol de glucosa, polo qu'esta vía ye pocu eficiente al respective de la fase aeróbica de la glucólisis.
El tipu de fermentadura varia respectu al tipu d'organismos: en lleldos, produzse fermentadura alcohólica, produciendo etanol y CO2 como productos finales, ente qu'en músculu, eritrocitos y dellos microorganismos produzse fermentadura láctica, que da como resultáu acedu láctico o lactato.
Funciones[editar | editar la fonte]
Les funciones de la glucólisis son:
- La xeneración de molécules d'alta enerxía (ATP y NADH) como fonte d'enerxía celular en procesos de respiración aeróbica (presencia d'osíxenu) y fermentadura (ausencia d'osíxenu).
- La xeneración de piruvato que va pasar al ciclu de Krebs, como parte de la respiración aeróbica.
- La producción d'intermediarios de 6 y 3 carbonos que pueden ser utilizaos n'otros procesos celulares.
Etapes de la glucólisis[editar | editar la fonte]
La glucólisis estremar en dos partes principales y diez reacciones enzimáticas, que se describen de siguío.
Fase de gastu d'enerxía (ATP)[editar | editar la fonte]
Esta primer fase de la glucólisis consiste en tresformar una molécula de glucosa en dos molécules de gliceraldehído.
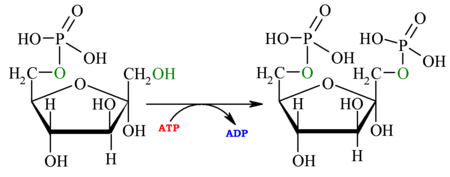
| 1ᵉʳ pasu: Hexoquinasa | ||||
|---|---|---|---|---|
| La primer reacción de la glucólisis ye la fosforilación de la glucosa, p'activala (aumentar la so enerxía) y asina poder utilizala n'otros procesos cuando seya necesariu. Esta activación asocede pola tresferencia d'un grupu fosfatu del ATP, una reacción catalizada pola enzima hexoquinasa,[5] la cual puede fosforilar (añader un grupu fosfatu) a molécules similares a la glucosa, como la fructosa y manosa. Les ventayes de fosforilar la glucosa son 2: La primera ye faer de la glucosa un metabolito más reactivu, mentáu enantes, y la segunda ventaya ye que la glucosa-6-fosfatu nun puede cruciar la membrana celular -a diferencia de la glucosa-yá que na célula nun esiste un tresportador de G6P. D'esta forma evita la perda de sustratu enerxéticu pa la célula. Téunicamente falando, la hexoquinasa solo fosforila les D-hexosas, y utiliza de sustratu MgATP2+, una y bones esti catión dexa que l'últimu fosfatu del ATP (fosfato gamma, γ-P o Pγ) seya un blancu más fácil pal ataque nucleofílico que realiza'l grupu hidroxilo (OH) del sestu carbonu de la glucosa, lo que ye posible debíu al Mg2+ que apantalla les cargues de los otros dos fosfatos.[1][6] Esta reacción tien un ΔG negativu, y por tanto tratar d'una reacción na que se pierde enerxía en forma de calor. En numberoses bacteries esta reacción ta acoplada a la última reacción de la glucólisis (de fosfoenolpiruvato a piruvato) pa poder aprovechar la enerxía sobrante de la reacción: el fosfatu del fosfoenolpiruvato tresferir d'una a otra proteína d'un sistema de tresporte fosfotransferasa, y n'última instancia, el fosfatu va pasar a una molécula de glucosa que ye tomada del esterior de la célula y lliberada en forma de G6P nel interior celular. Trátase por tanto d'acoplar la primera y l'última reacción d'esta vía y usar l'escedente d'enerxía pa realizar un tipu de tresporte al traviés de membrana denomináu translocación de grupu. |
| |||
| 2ᵘ pasu: Glucosa-6-P isomerasa | ||||
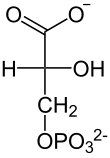
| Este ye un pasu importante, yá que equí defínese la xeometría molecular que va afectar los dos pasos críticos na glucólisis: El próximu pasu, que va amestar un grupu fosfatu al productu d'esta reacción, y el pasu 4, cuando se creen dos molécules de gliceraldehido que finalmente van ser los precursores del piruvato.[1] Nesta reacción, la glucosa-6-fosfatu se isomeriza a fructosa-6-fosfatu, por aciu la enzima glucosa-6-fosfatu isomerasa. La isomerización asocede nuna reacción de 4 pasos, qu'implica l'apertura del aniellu y un trespasu de protones al traviés d'un intermediariu cis-enediol[8]
Puesto que la enerxía llibre d'esta reacción ye igual a +1,7 kJ/mol la reacción ye non bonal y débese acoplar. |
| |||
| 3ᵉʳ pasu: Fosfofructoquinasa | ||||
| Fosforilación de la fructosa 6-fosfatu nel carbonu 1, con gastu d'un ATP, al traviés de la enzima fosfofructoquinasa-1 (PFK1). Tamién esti fosfatu va tener una baxa enerxía d'hidrólisis. Pol mesmu motivu que na primer reacción, el procesu ye irreversible. El nuevu productu va denominase fructosa-1,6-bisfosfato. La irreversibilidad ye importante, yá que la fai ser el puntu de control de la glucólisis. Como hai otros sustratos amás de la glucosa qu'entren na glucólisis, el puntu de control nun ta asitiáu na primer reacción, sinón nesta. La fosfofructoquinasa tien centros alostéricos, sensibles a les concentraciones d'intermediarios como citrato y ácidos grasos. Lliberando una enzima llamada fosfructocinasa-2 que fosforila nel carbonu 2 y regula la reacción. |
| |||
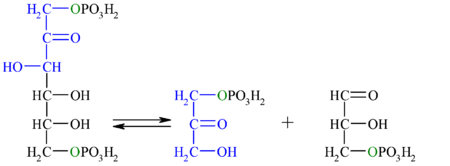
| 4ᵘ pasu: Aldolasa | ||||
| La enzima aldolasa (fructosa-1,6-bisfosfato aldolasa), por aciu una condensación aldólica reversible, ruempe la fructosa-1,6-bisfosfato en dos molécules de tres carbonos (triosas): dihidroxiacetona fosfatu y gliceraldehído-3-fosfatu. Esisten dos tipos de aldolasa, que difieren tantu nel tipu d'organismos onde s'espresen, como nos intermediarios de reacción.
Esta reacción tien una enerxía llibre (ΔG) ente 20 a 25 kJ/mol, polo tanto en condiciones estándar nun asocede de manera bonal. Sicasí, en condiciones intracelulares la enerxía llibre ye pequeña por cuenta de la baxa concentración de los sustratos, lo que dexa qu'esta reacción seya reversible.[1] |
| |||
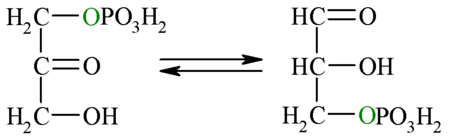
| 5ᵘ pasu: Triosa fosfatu isomerasa | ||||
| Puesto que solo'l gliceraldehído-3-fosfatu puede siguir los pasos restantes de la glucólisis, la otra molécula xenerada pola reacción anterior (dihidroxiacetona-fosfatu) ye isomerizada (convertida) en gliceraldehído-3-fosfatu. Esta reacción tien una enerxía llibre en condiciones estándar positiva, lo cual implicaría un procesu non favorecíu, sicasí al igual que pa la reacción 4, considerando les concentraciones intracelulares reales del reactivu y el productu, atópase que la enerxía llibre total ye negativa, polo que la direición favorecida ye escontra la formación de G3P.
Esti ye l'últimu pasu de la "fase de gastu d'enerxía". Solo consumióse ATP nel primer pasu (hexoquinasa) y el tercer pasu (fosfofructoquinasa-1). Cabo recordar que'l 4º pasu (aldolasa) xenera una molécula de gliceraldehído-3-fosfatu, ente que el 5º pasu xenera una segunda molécula d'este. D'equí d'equí p'arriba, les reacciones a siguir van asoceder dos veces, por cuenta de les 2 molécules de gliceraldehído xeneraes d'esta fase. Hasta esta reacción hai intervención d'enerxía (ATP). |
| |||
Fase de beneficiu enerxéticu (ATP, NADH)[editar | editar la fonte]
Hasta'l momentu solo consumióse enerxía (ATP), sicasí, na segunda etapa, el gliceraldehído ye convertíu a una molécula de muncha enerxía, onde finalmente se llogrará'l beneficiu final de 4 molécules de ATP.
| 6ᵘ pasu: Gliceraldehído-3-fosfatu deshidrogenasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Esta reacción consiste n'aferruñar el gliceraldehído-3-fosfatu utilizando NAD+ p'añader un ion fosfatu a la molécula, que ye realizada pola enzima gliceraldehído-3-fosfatu deshidrogenasa en 5 pasos, y de esta manera aumentar la enerxía del compuestu.
Téunicamente, el grupu aldehído aferruñar a un grupu acil-fosfatu, que ye un deriváu d'un carboxilo fosfatado. Esti compuestu tien una enerxía d'hidrólisis por demás alta (cercana a los 50 kJ/mol) polo que se da entamu al procesu de reacciones que van dexar recuperar el ATP más palantre. Mientres el grupu aldehído aferrúñase, el NAD+ amenórgase, lo que fai d'esta reacción una reacción redox. El NAD+ amenorgar pola incorporación de dalgún [H+] dando como resultáu una molécula de NADH de carga neutra. |
| ||||||||
| 7ᵘ pasu: Fosfoglicerato quinasa | |||||||||
| Nesti pasu, la enzima fosfoglicerato quinasa tresfier el grupu fosfatu de 1,3-bisfosfoglicerato a una molécula de ADP, xenerando asina la primer molécula de ATP de la vía. Como la glucosa tresformar en 2 molécules de gliceraldehído, en total recupérense 2 ATP nesta etapa. Nótese que la enzima foi nomada pola reacción inversa a l'amosada, y que esta opera en dambes direiciones.
Los pasos 6 y 7 de la glucólisis amuésennos un casu d'acoplamientu de reacciones, onde una reacción energéticamente desfavorable (pasu 6) ye siguida por una reacción bien favorable energéticamente (pasu 7) qu'induz la primer reacción. N'otres pallabres, como la célula caltener n'equilibriu, el descensu nes reserves de 1,3-bisfosfoglicerato emburria a la enzima GAP deshidrogenasa a aumentar les sos reserves. La cuantificación de la enerxía llibre pal acople de dambes reacciones ye d'alredor de -12 kJ/mol. Esta manera de llograr ATP ensin la necesidá d'O2 denominar fosforilación a nivel de sustratu. |
| ||||||||
| 8ᵘ pasu: Fosfoglicerato mutasa | |||||||||
| Se isomeriza el 3-fosfoglicerato procedente de la reacción anterior dando 2-fosfoglicerato, la enzima que cataliza esta reacción ye la fosfoglicerato mutasa. Lo único qu'asocede equí ye'l cambéu de posición del fosfatu del C3 al C2. Son enerxíes similares y por tanto reversibles, con una variación d'enerxía llibre cercana a cero. |
| ||||||||
| 9ᵘ pasu: Enolasa | |||||||||
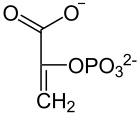
| La enzima enolasa favorez la formación d'un doble enllaz nel 2-fosfoglicerato, esaniciando una molécula d'agua formada pol hidróxenu del C2 y l'OH del C3. La resultancia ye'l fosfoenolpiruvato. |
| ||||||||
| 10ᵘ pasu: Piruvato quinasa | |||||||||
| Desfosforilación del fosfoenolpiruvato, llográndose piruvato y ATP. Reacción irreversible mediada pola piruvato quinasa. |
| ||||||||
La enzima piruvato quinasa ye dependiente de magnesiu y potasiu. La enerxía llibre ye de -31,4 kJ/mol, polo tanto la reacción ye favorable y irreversible.
El rendimientu total de la glucólisis d'una sola glucosa (6C) ye de 2 ATP y non 4 (dos por cada gliceraldehído-3-fosfatu (3C)), yá que se peracaben 2 ATP na primer fase, y 2 NADH (que van dexar los electrones Nc na cadena de tresporte d'electrones pa formar 3 ATP per cada electrón). Cola molécula de piruvato, por aciu un pasu d'oxidación entemediu llamáu descarboxilación oxidativa, por aciu el cual el piruvato pasa al interior de la mitocondria, perdiendo CO2 y un electrón qu'aferruña'l NAD+, que pasa a ser NADH más H+ y ganando un CoA-SH (coenzima A), formándose en acetil-CoA gracies a la enzima piruvato deshidrogenasa, puede entrase al ciclu de Krebs (que, xunto cola cadena de tresporte d'electrones, denominar respiración).
Regulación[editar | editar la fonte]
L'efeutu Pasteur[editar | editar la fonte]
L'efeutu Pasteur ye la visualización del poder que tien l'O2 na fermentadura mediada por lleldu, que foi afayáu por Louis Pasteur al reparar la rellación ente la tasa de fermentadura y l'esistencia d'aire. Él determinó qu'estes teníen una rellación inversa, y amás reparó qu'en condiciones aeróbicas, les célules de lleldu aumentaben y la fermentadura menguaba.
D'esta manera, l'efeutu Pasteur foi una de les primeres observaciones que daquién realizó al procesu de la glucólisis de manera indireuta, pero reparando que'l metabolismu primariu de glucosa podía realizase con presencia o ausencia d'osíxenu, y que nesti postreru asocede la fermentadura alcohólica.
Regulación del sustratu[editar | editar la fonte]
La membrana plasmática de les célules ye impermeable a la glucosa. Pa llevala dientro d'ella utiliza tresportadores especiales llamaos GLUT, de los cualos hai distintos tipos y dellos especializaos pa cada célula.
Regulación de l'actividá enzimática[editar | editar la fonte]

La glucólisis regúlase enzimáticamente nos trés puntos irreversibles d'esta ruta, esto ye, na primer reacción (G → G-6P), per mediu de la hexoquinasa; na tercer reacción (F-6P → F-1,6-BP) per mediu de la PFK1 y nel últimu pasu (PEP → Piruvato) pola piruvato quinasa.
- La hexoquinasa ye un puntu de regulación pocu importante, yá que se inhibe cuando hai enforma G-6P en músculu. Ye un puntu pocu importante una y bones el G-6P utilizar pa otres víes.
- La fosfofructoquinasa-1 ye la enzima principal de la regulación de la glucólisis, actúa como una llave d'agua, si ta activa cataliza munches reacciones y llógrase más fructosa-1,6-bisfosfato, lo que va dexar a les enzimes siguientes tresformar enforma piruvato. Si ta tornada, llógrense baxes concentraciones de productu y polo tanto llógrase pocu piruvato. Esta enzima ye controlada por regulación alostérica: per un sitiu actívase por concentraciones elevaes de ADP y AMP, tornándose a esgaya de ATP y citrato, y por otru actívase en presencia d'un regulador xeneráu pola PFK2 que ye la fructosa-2,6-bisfosfato (F-2,6-BP), que nun ye un metabolito nin de la glucólisis nin de la gluconeogénesis, sinón un regulador de dambes víes que reflexa'l nivel de glucagón en sangre.
- La lóxica de la inhibición y activación son les siguientes:
- ATP: inhibe esta enzima pos si hai una alta concentración de ATP entós la célula nun precisa xenerar más.
- Citrato: Si la concentración de citrato ye alta'l Ciclu de Krebs va más adulces de lo que'l sustratu (acetil-CoA) llega pa degradase, y la concentración de glucosa va ser más alta. Nel Ciclu de Krebs produzse enforma NADH y FADH2, por que funcionen haber de reoxidar na cadena de tresporte electrónicu creando gradiente de protones, si'l gradiente nun se gastar los coenzimes non se reoxidan y el Ciclu de Krebs párase.
- AMP, ADP: l'alta concentración d'estes molécules implica qu'hai una falta de ATP, polo que ye necesariu realizar glucólisis, pa xenerar piruvato y enerxía.
- La piruvatoquinasa regúlase distinto según el texíu nel que trabaye, pero en fégadu se inhibe en presencia de ATP y Acetil Coenzima-A (Acetil-CoA), y actívase gracies de nuevu ante la F-1,6-BP y la concentración de fosfoenolpiruvato.
Regulación hormonal[editar | editar la fonte]
Al aumentar la glucosa nel sangre, dempués d'una comida, les célules beta del páncrees aguiyen la producción d'insulina, y esta de la mesma aumenta l'actividá de la glucoquinasa nos hepatocitos.
Les concentraciones altes de glucagon y les baxes d'insulina mengüen la concentración intracelular de fructosa-1,6-bisfosfato. Esto trai por consecuencia l'amenorgamientu de la glucólisis y l'aumentu de la gluconeogenésis.
Producción de glucosa[editar | editar la fonte]
La gluconeoxénesis ye la ruta anabólica pola que tien llugar la síntesis de nueva glucosa a partir de precursores non glucosídicos (lactato, piruvato, glicerol y dellos aminoácidos). Llevar a cabu principalmente nel fégadu, y en menor midida na corteza renal. Ye estímulada pola hormona glucagón, secretada poles célules α (alfa) de los castros de Langerhans del páncrees y ye tornada pol so contrarreguladora, la hormona insulina, secretada poles célules β (beta) de los castros de Langerhans del páncrees, que estímula la ruta catabólica llamada glucoxenólisis pa degradar el glucóxenu almacenáu y tresformalo en glucosa y asina aumentar la glucemia (azucre en sangre).
Dende'l puntu de vista enzimáticu, producir glucosa dende láctico o piruvato cuesta más de lo que produció la so degradación fosfórica.
La ecuación global ye:
| 2 piruvato + 4 ATP + 2 GTP + 2 NADH + 2 H+ + 4 H 2O → glucosa + 4 ADP + 2 GDP + 6 [[fosfatu inorgánicu| (Pi)]] + 2 NAD+ |
Glucólisis en plantes[editar | editar la fonte]
Les plantes tienen la capacidá de realizar la fotosíntesis, y ente los subproductos d'esti procesu ta la glucosa. Esta ye usada poles plantes, ente munches coses, como fonte d'enerxía nel procesu de respiración, que a diferencia de la fotosíntesis ye executáu independientemente de la lluz. Al alendar les plantes absuerben osíxenu del aire y espulsen dióxidu de carbonu y vapor d'agua. L'intercambiu de sustancies realícenlo les estomes; abertures qu'actúen como compuertes nes plantes qu'amás tienen la carauterística de cerrase ante un descensu escesivu del vapor atmosféricu.[9]
Referencies[editar | editar la fonte]
- ↑ 1,0 1,1 1,2 1,3 1,4 David Nelson & Michael Cox (2004). «Glycolysis, Gluconeogenesis and the Pentose Phosphate Pathway», Lehningher's Principles of Biochemistry. W.H.Freeman. 0716743396.
- ↑ Papers de Pasteur
- ↑ Romanu AH & Conway T. Evolution of carbohydrate metabolic pathways. Res Microbiol. 147(6-7):448-55 (1996) PMID 9084754
- ↑ Nun s'usen los intermediarios xeneraos, sinón que per mediu de les danzaderes vuelven crease dientro de la mitocondria. Por esto llámase-yos los sos equivalentes. Pa una visión química, visitar equivalentes
- ↑ Meyerhof, O. Ueber die enzymatische Milch-säurebildung im Muskelextrakt; die Milch-säurebildung aus dean gärfähigen Hexosen. Biochem Z. 183:176 (1927)
- ↑ Colowick, S. y Kalckar H.. The role of myokinase in trans-phosphorylations; the enzymatic phosphorylation of hexoses by adenyl pyrophosphate. J. Biol. Chem. 148: 117 (1943).
- ↑ 7,00 7,01 7,02 7,03 7,04 7,05 7,06 7,07 7,08 7,09 Valores tomaos de Lehningher's Principles of Biochemistry (ISBN 0-7167-4339-6) y del Volume 3 de Biochemistry por J. Stenesh (ISBN 0-306-45733-4)
- ↑ Irwin A. Rose (2006). «Mechanism of the Aldose-Ketose Isomerase Reactions», Advances in Enzymology - and Related Areas of Molecular Biology, Volume 43. Wiley Interscience. ISBN 0471591788. - doi 10.1002/9780470122884.ch6
- ↑ «Funciones de les plantes». Consultáu'l 30 d'agostu de 2011.
moli
Ver tamién[editar | editar la fonte]
Enllaces esternos[editar | editar la fonte]
- soko.com.ar: Esplicación más estensa
- www2.ufp.pt: A lóxica química da Glicólise (Portugués)
- www.pdb.org: The Glycolytic Enzymes, información en Protein Data Bank (n'inglés)
- to7sKFh0w&list=PLE21A11C7Y7D1D26D Esplicación del procesu de glucólisis (Youtube)