Diferencies ente revisiones de «Configuración electrónica»
m Preferencies llingüístiques: -"característica" +"carauterística" |
m Iguo plurales |
||
| Llinia 50: | Llinia 50: | ||
==Enerxía. Estáu estacionariu y estáu escitáu== |
==Enerxía. Estáu estacionariu y estáu escitáu== |
||
La enerxía asociada a un electrón ye la que tien nel so orbital. La enerxía d'una configuración tien, a menudu, un valor aproximáu al sumatoriu de la enerxía de cada electrón, descartándose nel cálculu les interacciones ente electrones. La configuración que correspuende al nivel más baxu d'enerxía llámase [[estáu estacionariu (mecánica cuántica)|estáu estacionariu]] del átomu; cualisquier otra configuración ye un [[estáu escitáu (mecánica cuántica)|estáu escitáu]]. Asina, por exemplu, l'estáu estacionariu del átomu de [[sodiu]] ye la configuración 1s |
La enerxía asociada a un electrón ye la que tien nel so orbital. La enerxía d'una configuración tien, a menudu, un valor aproximáu al sumatoriu de la enerxía de cada electrón, descartándose nel cálculu les interacciones ente electrones. La configuración que correspuende al nivel más baxu d'enerxía llámase [[estáu estacionariu (mecánica cuántica)|estáu estacionariu]] del átomu; cualisquier otra configuración ye un [[estáu escitáu (mecánica cuántica)|estáu escitáu]]. Asina, por exemplu, l'estáu estacionariu del átomu de [[sodiu]] ye la configuración 1s²2s²2p⁶3s¹, como puede deducise fácilmente de l'aplicación del principiu d'Aufbau. El primer estáu escitáu obtiénse llevando un electrón del orbital 3s al 3p pa obtener la configuración 1s²2s²2p⁶3p, conocida abreviadamente como nivel 3p del átomu de sodiu. Los átomos pueden pasar d'una configuración a otra emitiendo o absorbiendo enerxía. Nuna [[llámpara de vapor de sodiu]], por exemplu, los átomos de sodiu son escitaos al so nivel 3p por una descarga eléctrica, y vuelven a la so configuración estacionaria emitiendo lluz mariella con una [[llonxitú d'onda]] de 589 nm. |
||
Por regla xeneral, la escitación d'electrones de valencia (como'l 3s del sodiu) rellaciónase con enerxía en forma de fotones de lluz visible o [[radiación ultraviola|ultraviola]]. Ye posible tamién escitar los electrones centrales, pero fai falta muncha más enerxía, xeneralmente correspondientes a fotones de [[rayos X]]. Con ellos podríase, nel exemplu citáu, escitar un electrón 2p al nivel 3s pa formar la configuración 1s |
Por regla xeneral, la escitación d'electrones de valencia (como'l 3s del sodiu) rellaciónase con enerxía en forma de fotones de lluz visible o [[radiación ultraviola|ultraviola]]. Ye posible tamién escitar los electrones centrales, pero fai falta muncha más enerxía, xeneralmente correspondientes a fotones de [[rayos X]]. Con ellos podríase, nel exemplu citáu, escitar un electrón 2p al nivel 3s pa formar la configuración 1s²2s²2p⁵3s². |
||
Nel restu d'esti artículu falaremos, sacante que se diga lo contrariu, del estáu estacionariu de los átomos o molécules, consideráu xeneralmente como "la" so configuración habitual. |
Nel restu d'esti artículu falaremos, sacante que se diga lo contrariu, del estáu estacionariu de los átomos o molécules, consideráu xeneralmente como "la" so configuración habitual. |
||
==Notación== |
==Notación== |
||
Físicos y químicos empleguen una notación estándar pa señalar les configuraciones electróniques de los átomos y les molécules. Nel casu de los átomos, la notación consiste nuna secuencia de les diverses subcapes atómiques (por exemplu, al [[fósforu]] correspuénde-y la secuencia 1s, 2s, 2p, 3s, 3p) na qu'el númberu d'electrones asignáu a cada subcapa aparez indicáu en forma de superíndiz. Asina, l'[[hidróxenu]] tien un electrón nel orbital ''s'' de la primer capa; poro, la so configuración escríbese 1s |
Físicos y químicos empleguen una notación estándar pa señalar les configuraciones electróniques de los átomos y les molécules. Nel casu de los átomos, la notación consiste nuna secuencia de les diverses subcapes atómiques (por exemplu, al [[fósforu]] correspuénde-y la secuencia 1s, 2s, 2p, 3s, 3p) na qu'el númberu d'electrones asignáu a cada subcapa aparez indicáu en forma de superíndiz. Asina, l'[[hidróxenu]] tien un electrón nel orbital ''s'' de la primer capa; poro, la so configuración escríbese 1s¹. El litiu, pela so banda, tien dos electrones na subcapa 1s y ún na 2s, y la so configuración escríbese 1s² 2s¹ . El fósforu, nesta notación, escríbese asina: 1s² 2s² 2p⁶ 3s² 3p³. |
||
[[Imaxe:Periodic_Table_of_Elements_showing_Electron_Shells.svg|440px|thumb|right|Tabla periódica con detalle de les capes electróniques de cada elementu.]] |
[[Imaxe:Periodic_Table_of_Elements_showing_Electron_Shells.svg|440px|thumb|right|Tabla periódica con detalle de les capes electróniques de cada elementu.]] |
||
Esti sistema ye abegosu pa emplegalu pa notar átomos con munchos electrones, lo que llevó a la creación d'un sistema de notación abreviada. La configuración electrónica espresase como la xunión de los electrones centrales, equivalentes a los del [[gas noble]] del [[periodu de la tabla periódica|periodu]] precedente, y los [[electrón de valencia|electrones de valencia]], una y bones los elementos d'un mesmu periodu diferénciense namái nel númberu d'electrones de les últimes subcapes. El fósforu, por exemplu, ta nel tercer periodu, y diferénciase del [[neón]], el gas noble del segundu periodu, de configuración 1s |
Esti sistema ye abegosu pa emplegalu pa notar átomos con munchos electrones, lo que llevó a la creación d'un sistema de notación abreviada. La configuración electrónica espresase como la xunión de los electrones centrales, equivalentes a los del [[gas noble]] del [[periodu de la tabla periódica|periodu]] precedente, y los [[electrón de valencia|electrones de valencia]], una y bones los elementos d'un mesmu periodu diferénciense namái nel númberu d'electrones de les últimes subcapes. El fósforu, por exemplu, ta nel tercer periodu, y diferénciase del [[neón]], el gas noble del segundu periodu, de configuración 1s² 2s² 2p⁶, namái pola presencia d'una tercer capa. La parte de la so configuración igual a la del neón abreviase como [Ne], y eso permite que pueda notase'l fósforu como [Ne] 3s² 3p³ en cuenta de facelo per estensu. Esta convención ye útil, una y bones son los electrones de la capa más esterna los que más influin nes carauterístiques químiques d'un elementu. |
||
Sicasí, l'orde d'escritura de los orbitales nun ta completamente afitáu, porque namái les ocupaciones orbitales tienen significación física. Por exemplu, la configuración electrónica del [[titaniu]] n'estáu basal puede escribise [Ar] 4s |
Sicasí, l'orde d'escritura de los orbitales nun ta completamente afitáu, porque namái les ocupaciones orbitales tienen significación física. Por exemplu, la configuración electrónica del [[titaniu]] n'estáu basal puede escribise [Ar] 4s² 3d² o [Ar] 3d² 4s². La primer notación sigue l'orde, basáu na [[principiu d'Aufbau|regla de Madelung]] pa la configuración de los átomos neutros: 4s enllénase enantes de 3d na secuencia Ar, K, Ca, Sc, Ti. La segunda notación axunta tolos orbitales col mesmu valor de ''n''', y correspuende al orde espectroscópicu de les enerxíes orbitales, que representa el contrariu del orde nel que los electrones son arrancaos d'un átomu determináu pa formar iones positivos: 3d enllénase enantes de 4s na secuencia Ti4+, Ti3+, Ti2+, Ti+, Ti. |
||
Tampoco ye obligatorio escribir 1 nel superíndiz d'una subcapa ocupada namái por un electrón; asina, l'[[aluminiu]] puede escribise [Ne] 3s |
Tampoco ye obligatorio escribir 1 nel superíndiz d'una subcapa ocupada namái por un electrón; asina, l'[[aluminiu]] puede escribise [Ne] 3s² 3p¹ o [Ne] 3s² 3p. Ye habitual, tamién, ver les lletres de los niveles orbitales (s, p, d, f) escritos en lletra itálica o cursiva, magar que la [[Unión Internacional de Química Pura y Aplicada]] recomienda un tipu de lletra normal. L'orixe de les lletres utilizaes alcuéntrase nún sistema, anguaño desaniciáu por obsoletu, de categorización de les llínies espectrales como aguda (''sharp''), principal (''principal''), difusa (''diffuse'') y fundamental (''fine'') a partir de la estructura que presenten a la observación. El so usu modernu indica orbitales con un númberu cuánticu azimutal, ''l'', de 0, 1, 2 y 3 respeutivamente. Tres de la "f" la secuencia continúase alfabéticamente, cola "g", "h", "i"... (l = 4, 5, 6...). Magar que ye poco frecuente, porque los orbitales de ''l'' 7 son poco utilizaos, caso de necesitar escribise sáltase la lletra "j"<ref>[http://scienceworld.wolfram.com/physics/ElectronOrbital.html Weisstein, Eric W., ''Electron Orbital'' na web wolfram.com (2007).]</ref><ref>Ebbing, Darrell D., Gammon, Steven D., ''General Chemistry''. Cengage Learning, 2007, p. 284. ISBN 978-0-618-73879-3.</ref>. |
||
La configuración electrónica de les molécules escríbese de forma asemeyada, cola única diferencia de qu'en cuenta de los niveles orbitales atómicos úsense los niveles orbitales moleculares. |
La configuración electrónica de les molécules escríbese de forma asemeyada, cola única diferencia de qu'en cuenta de los niveles orbitales atómicos úsense los niveles orbitales moleculares. |
||
| Llinia 70: | Llinia 70: | ||
La utilidá más estendida de les configuraciones electróniques ye que permite la racionalización de les propiedaes químicas, neto en química orgánica que na inorgánica. Dafechamente, les configuraciones electróniques, xunto con una forma simplificada de la teoría orbital molecular, tienen convertíose nel equivalente modernu del conceptu de [[valencia (química)|valencia]], y úsense pa describir el númberu y tipo de les xuniones químiques qu'un átomu puede formar. |
La utilidá más estendida de les configuraciones electróniques ye que permite la racionalización de les propiedaes químicas, neto en química orgánica que na inorgánica. Dafechamente, les configuraciones electróniques, xunto con una forma simplificada de la teoría orbital molecular, tienen convertíose nel equivalente modernu del conceptu de [[valencia (química)|valencia]], y úsense pa describir el númberu y tipo de les xuniones químiques qu'un átomu puede formar. |
||
Esti enfoque ye lleváu un pasu más allá na [[química computacional]], que tenta siempre de facer estimaciones cuantitatives de les propiedaes químiques. Demientres munchos años la mayoría d'esos cálculos usaben una aproximación LCAO (sigles de "combinación lineal d'orbitales atómicos"), usando un conxuntu de bases d'orbitales atómicos grande y complexu como puntu de partida. L'últimu pasu nesos cálculos ye l'asignación d'electrones a los diversos orbitales moleculares acordies col principiu d'Aufbau. Nostante, non |
Esti enfoque ye lleváu un pasu más allá na [[química computacional]], que tenta siempre de facer estimaciones cuantitatives de les propiedaes químiques. Demientres munchos años la mayoría d'esos cálculos usaben una aproximación LCAO (sigles de "combinación lineal d'orbitales atómicos"), usando un conxuntu de bases d'orbitales atómicos grande y complexu como puntu de partida. L'últimu pasu nesos cálculos ye l'asignación d'electrones a los diversos orbitales moleculares acordies col principiu d'Aufbau. Nostante, non tolos métodos de la química computacional tán basaos na configuración electrónica; la teoría de la densidá funcional, por exemplu, nun la utiliza. |
||
Nos átomos o molécules con más d'un electrón el movimientu de los electrones correlaciónase eléctricamente, polo que la configuración electrónica nun ye exacta: necesítense un númberu munchu mayor de configuraciones electróniques pa describir esactamente cualisquier sistema con más d'un electrón, y nun puede asociase dengún nivel d'enerxía con una única configuración. Sicasí, la función de les ondes electróniques suele correspondese con un númberu perpequeñu de configuraciones, polo qu'el conceptu de configuración electrónica sigue siendo básicu pa conocer los sistemes con varios electrones. |
Nos átomos o molécules con más d'un electrón el movimientu de los electrones correlaciónase eléctricamente, polo que la configuración electrónica nun ye exacta: necesítense un númberu munchu mayor de configuraciones electróniques pa describir esactamente cualisquier sistema con más d'un electrón, y nun puede asociase dengún nivel d'enerxía con una única configuración. Sicasí, la función de les ondes electróniques suele correspondese con un númberu perpequeñu de configuraciones, polo qu'el conceptu de configuración electrónica sigue siendo básicu pa conocer los sistemes con varios electrones. |
||
Revisión a fecha de 15:32 17 ago 2019

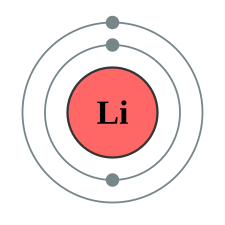
Nómase configuración electrónica, en física atómica y química cuántica, a la distribución de los electrones d'un átomu o molécula (o otra estructura física) n'orbitales atómicos o moleculares[1].
Les configuraciones electróniques describen a cada electrón como si se moviera de forma independiente nún orbital, nún campu mediu creáu por tolos otros orbitales. Les configuraciones descríbense, en términos matemáticos, por determinantes de Slater o funciones d'estáu de configuración.
Acordies coles lleis de la mecánica cuántica, nos sistemes con un únicu electrón hai una enerxía asociada con cada configuración electrónica. Amás, si se dan determinaes condiciones, los electrones son capaces de movese d'una configuración a otra emitiendo o absorbiendo un cuantu d'enerxía en forma de fotón.
El conocimientu de la configuración electrónica de los diferentes átomos ye útil pa entender la estructura de la tabla periódica d'elementos, y tamién pa describir les xuniones químicas que mantienen los átomos xuníos. Ye útil, finalmente, p'axudar a desplicar les propiedaes de los láseres y los semiconductores.
Capes y subcapes electróniques
| s (ℓ=0) | p (ℓ=1) | |||
|---|---|---|---|---|
| m=0 | m=0 | m=±1 | ||
| s | pz | px | py | |
| n=1 | 
|
|||
| n=2 | 
|

|

|

|
La configuración electrónica foi concebida dientru del modelu teóricu d'estructura del átomu de Bohr, y, magar los avances na comprensión de la naturaleza cuántica de los electrones, entá ye habitual falar de capes y subcapes orbitales.
Una capa electrónica ye'l conxuntu d'estaos cuánticos posibles que comparten el mesmu númberu cuánticu principal, n (el númberu que va delantre de la lletra na notación orbital) que puede ser ocupado por electrones. Cualisquier capa con un númberu n puede agospiar 2n2 electrones. Esto ye, na primer capa pueden acomodase dos, na segunda 8 y na tercera 18. L'aumentu del factor de 2 debese a que los estaos cuánticos posibles dóblense pola esistencia del espín: cada orbital atómicu almite dos electrones idénticos que tengan un espín opuestu, ún con un espín +1/2 (representáu xeneralmente como una flecha qu'apunta p'arriba) y otru con un espín -1/2 (representáu por una flecha qu'apunta p'abaxu).
Una subcapa electrónica ye'l conxuntu d'estaos cuánticos posibles que comparten, dientro d'una capa, el mesmu númberu cuánticu azimutal. Los valores ℓ = 0, 1, 2, 3 correspuenden, respeutivamente, a los niveles s, p, d, and f labels. Asina, por exemplu, la subcapa 3d tien n = 3 y ℓ = 2. El númberu máximu d'electrones que pueden asitiase nuna capa defínelu la espresión 2(2ℓ+1). Acordies con ella, habrá dos electrones nuna subcapa s , seis nuna subcapa p , 10 nuna subcapa d y 14 nuna subcapa f .
El númberu d'electrones que pueden ocupar cada capa y subcapa obtiénense a partir de les ecuaciones de la mecánica cuántica; en particular del principiu d'exclusión de Pauli, qu'establez que ye imposible que dos electrones del mesmu átomu tengan los mesmos valores de los cuatro númberos cuánticos[2].
Enerxía. Estáu estacionariu y estáu escitáu
La enerxía asociada a un electrón ye la que tien nel so orbital. La enerxía d'una configuración tien, a menudu, un valor aproximáu al sumatoriu de la enerxía de cada electrón, descartándose nel cálculu les interacciones ente electrones. La configuración que correspuende al nivel más baxu d'enerxía llámase estáu estacionariu del átomu; cualisquier otra configuración ye un estáu escitáu. Asina, por exemplu, l'estáu estacionariu del átomu de sodiu ye la configuración 1s²2s²2p⁶3s¹, como puede deducise fácilmente de l'aplicación del principiu d'Aufbau. El primer estáu escitáu obtiénse llevando un electrón del orbital 3s al 3p pa obtener la configuración 1s²2s²2p⁶3p, conocida abreviadamente como nivel 3p del átomu de sodiu. Los átomos pueden pasar d'una configuración a otra emitiendo o absorbiendo enerxía. Nuna llámpara de vapor de sodiu, por exemplu, los átomos de sodiu son escitaos al so nivel 3p por una descarga eléctrica, y vuelven a la so configuración estacionaria emitiendo lluz mariella con una llonxitú d'onda de 589 nm.
Por regla xeneral, la escitación d'electrones de valencia (como'l 3s del sodiu) rellaciónase con enerxía en forma de fotones de lluz visible o ultraviola. Ye posible tamién escitar los electrones centrales, pero fai falta muncha más enerxía, xeneralmente correspondientes a fotones de rayos X. Con ellos podríase, nel exemplu citáu, escitar un electrón 2p al nivel 3s pa formar la configuración 1s²2s²2p⁵3s².
Nel restu d'esti artículu falaremos, sacante que se diga lo contrariu, del estáu estacionariu de los átomos o molécules, consideráu xeneralmente como "la" so configuración habitual.
Notación
Físicos y químicos empleguen una notación estándar pa señalar les configuraciones electróniques de los átomos y les molécules. Nel casu de los átomos, la notación consiste nuna secuencia de les diverses subcapes atómiques (por exemplu, al fósforu correspuénde-y la secuencia 1s, 2s, 2p, 3s, 3p) na qu'el númberu d'electrones asignáu a cada subcapa aparez indicáu en forma de superíndiz. Asina, l'hidróxenu tien un electrón nel orbital s de la primer capa; poro, la so configuración escríbese 1s¹. El litiu, pela so banda, tien dos electrones na subcapa 1s y ún na 2s, y la so configuración escríbese 1s² 2s¹ . El fósforu, nesta notación, escríbese asina: 1s² 2s² 2p⁶ 3s² 3p³.

Esti sistema ye abegosu pa emplegalu pa notar átomos con munchos electrones, lo que llevó a la creación d'un sistema de notación abreviada. La configuración electrónica espresase como la xunión de los electrones centrales, equivalentes a los del gas noble del periodu precedente, y los electrones de valencia, una y bones los elementos d'un mesmu periodu diferénciense namái nel númberu d'electrones de les últimes subcapes. El fósforu, por exemplu, ta nel tercer periodu, y diferénciase del neón, el gas noble del segundu periodu, de configuración 1s² 2s² 2p⁶, namái pola presencia d'una tercer capa. La parte de la so configuración igual a la del neón abreviase como [Ne], y eso permite que pueda notase'l fósforu como [Ne] 3s² 3p³ en cuenta de facelo per estensu. Esta convención ye útil, una y bones son los electrones de la capa más esterna los que más influin nes carauterístiques químiques d'un elementu.
Sicasí, l'orde d'escritura de los orbitales nun ta completamente afitáu, porque namái les ocupaciones orbitales tienen significación física. Por exemplu, la configuración electrónica del titaniu n'estáu basal puede escribise [Ar] 4s² 3d² o [Ar] 3d² 4s². La primer notación sigue l'orde, basáu na regla de Madelung pa la configuración de los átomos neutros: 4s enllénase enantes de 3d na secuencia Ar, K, Ca, Sc, Ti. La segunda notación axunta tolos orbitales col mesmu valor de n', y correspuende al orde espectroscópicu de les enerxíes orbitales, que representa el contrariu del orde nel que los electrones son arrancaos d'un átomu determináu pa formar iones positivos: 3d enllénase enantes de 4s na secuencia Ti4+, Ti3+, Ti2+, Ti+, Ti.
Tampoco ye obligatorio escribir 1 nel superíndiz d'una subcapa ocupada namái por un electrón; asina, l'aluminiu puede escribise [Ne] 3s² 3p¹ o [Ne] 3s² 3p. Ye habitual, tamién, ver les lletres de los niveles orbitales (s, p, d, f) escritos en lletra itálica o cursiva, magar que la Unión Internacional de Química Pura y Aplicada recomienda un tipu de lletra normal. L'orixe de les lletres utilizaes alcuéntrase nún sistema, anguaño desaniciáu por obsoletu, de categorización de les llínies espectrales como aguda (sharp), principal (principal), difusa (diffuse) y fundamental (fine) a partir de la estructura que presenten a la observación. El so usu modernu indica orbitales con un númberu cuánticu azimutal, l, de 0, 1, 2 y 3 respeutivamente. Tres de la "f" la secuencia continúase alfabéticamente, cola "g", "h", "i"... (l = 4, 5, 6...). Magar que ye poco frecuente, porque los orbitales de l 7 son poco utilizaos, caso de necesitar escribise sáltase la lletra "j"[3][4].
La configuración electrónica de les molécules escríbese de forma asemeyada, cola única diferencia de qu'en cuenta de los niveles orbitales atómicos úsense los niveles orbitales moleculares.
Aplicaciones
La utilidá más estendida de les configuraciones electróniques ye que permite la racionalización de les propiedaes químicas, neto en química orgánica que na inorgánica. Dafechamente, les configuraciones electróniques, xunto con una forma simplificada de la teoría orbital molecular, tienen convertíose nel equivalente modernu del conceptu de valencia, y úsense pa describir el númberu y tipo de les xuniones químiques qu'un átomu puede formar.
Esti enfoque ye lleváu un pasu más allá na química computacional, que tenta siempre de facer estimaciones cuantitatives de les propiedaes químiques. Demientres munchos años la mayoría d'esos cálculos usaben una aproximación LCAO (sigles de "combinación lineal d'orbitales atómicos"), usando un conxuntu de bases d'orbitales atómicos grande y complexu como puntu de partida. L'últimu pasu nesos cálculos ye l'asignación d'electrones a los diversos orbitales moleculares acordies col principiu d'Aufbau. Nostante, non tolos métodos de la química computacional tán basaos na configuración electrónica; la teoría de la densidá funcional, por exemplu, nun la utiliza.
Nos átomos o molécules con más d'un electrón el movimientu de los electrones correlaciónase eléctricamente, polo que la configuración electrónica nun ye exacta: necesítense un númberu munchu mayor de configuraciones electróniques pa describir esactamente cualisquier sistema con más d'un electrón, y nun puede asociase dengún nivel d'enerxía con una única configuración. Sicasí, la función de les ondes electróniques suele correspondese con un númberu perpequeñu de configuraciones, polo qu'el conceptu de configuración electrónica sigue siendo básicu pa conocer los sistemes con varios electrones.
Otra aplicación fundamental de la configuración electrónica ye la intepretación del espectru d'emisión. Pa esti fin ye necesario complementar la configuración electrónica con ún o más símbolos de términu, que describen los diferentes niveles d'enerxía disponibles pa cada átomu. Los símbolos de términu pueden ser calculaos pa cada configuración electrónica, y non namái pa los estaos estacionarios o basales qu'aparecen llistaos en tables, magar que non se pueden ver, na práutica, tolos niveles d'enerxía. Foi al traviés del análisis del espectru d'emisión como se determinó experimentalmente la configuración electrónica de los elementos nel so estáu estacionariu.
Referencies
- ↑ "Configuración electrónica" nel Compendium of Chemical Terminology (the "Gold Book"), IUPAC (2ª ed. de 1997, revisada en 2006).
- ↑ "Principiu d'exclusión de Pauli" nel Compendium of Chemical Terminology (the "Gold Book"), IUPAC (2ª ed. de 1997, revisada en 2006).
- ↑ Weisstein, Eric W., Electron Orbital na web wolfram.com (2007).
- ↑ Ebbing, Darrell D., Gammon, Steven D., General Chemistry. Cengage Learning, 2007, p. 284. ISBN 978-0-618-73879-3.
