Nucleu atómicu
| Nucleu atómicu | |
|---|---|
| tipu de partícula cuántica | |
|
estado ligado (es) | |
 | |

El nucleu atómicu ye la parte central d'un átomu, tien carga positiva, y concentra más del 99,999% de la masa total del átomu.
Ta formáu por protones y neutrones (denominaos nucleones) que se caltienen xuníos per mediu de la interacción nuclear fuerte, que dexa que'l nucleu sía estable, a pesar de que los protones se repelen ente sigo (como los polos iguales de dos imanes). La cantidá de protones nel nucleu (númberu atómicu), determina'l elementu químicu al que pertenez. Los nucleos atómicos non necesariamente tienen el mesmu númberu de neutrones, yá qu'átomos d'un mesmu elementu pueden tener mases distintes, ye dicir son isótopos del elementu.
La esistencia del nucleu atómicu foi deducida del esperimentu de Rutherford, onde se bombardeó una llámina fina d'oru con partícules alfa, que son nucleos atómicos d'heliu emitíos por roques radiactives. La mayoría d'eses partícules trespasaben la llámina, pero delles rebotaban, lo cual demostró la esistencia d'un minúsculu nucleu atómicu.
Historia[editar | editar la fonte]
El descubrimientu de los electrones foi la primer indicación de la estructura interna de los átomos. A empiezos del sieglu XX el modelu aceptáu del átomu yera'l de JJ Thomson "pudín de pases" modelu nel cual l'átomu yera una gran bola de carga positiva colos pequeños electrones cargaos negativamente enllastráu dientro de la mesma. Entós daquella, los físicos afayaren tamién tres tipos de radiaciones procedentes de los átomos: alfa, beta y radiación gamma. Los esperimentos de 1911 realizaos por Lise Meitner y Otto Hahn, y por James Chadwick en 1914 amosaron que l'espectru de decaimiento beta ye continuu y non discretu. Esto ye, los electrones son espulsaos del átomu con una gama d'enerxíes, en cuenta de les cantidaes discretes d'enerxía que se repara en rayu gamma y decaimiento alfa. Esto paecía indicar que la enerxía nun se caltenía nestes escayencia. Darréu afayóse que la enerxía sí se caltién, col descubrimientu de los neutrinos.
En 1906 Ernest Rutherford publicó "El retrasu de la partícula alfa del radiu cuando traviesa la materia", en Philosophical Magacín (12, p. 134-46). Hans Geiger amplió esti trabayu nuna comunicación a la Royal Society (Proc. Roy. Soc. 17 de xunetu de 1908) con esperimentos y Rutherford fixérase pasar aire al traviés de les partícules α, papel d'aluminiu y papel d'aluminiu dorao. Geiger y Marsden publicaron trabayos adicionales en 1909 (Proc. Roy. Soc. A82 p. 495-500) y ampliaron entá más el trabayu na publicación de 1910 por Geiger (Proc. Roy. Soc. 1 de febreru de 1910). En 1911-2 Rutherford esplicó ante la Royal Society los esperimentos y propunxo la nueva teoría del nucleu atómicu. Polo que se considera que Rutherford demostró en 1911 la esistencia del nucleu atómicu.[1]
Por eses mesmes feches (1909) Ernest Rutherford realizó un esperimentu nel que Hans Geiger y Ernest Marsden, so la so supervisión dispararon partícules alfa (nucleos d'heliu) nuna delgada llámina d'oru. El modelu atómicu de Thomson predicía que la de les partícules alfa teníen de salir de la llámina con pequeñes esviaciones de les sos trayectories. Sicasí, afayó que delles partícules esvalixar a grandes ángulos, ya inclusive dafechu escontra tras en dellos casos. Esti descubrimientu en 1911, llevó al modelu atómicu de Rutherford, en que l'átomu ta constituyíu por protones y electrones. Asina, l'átomu del nitróxenu-14 taría constituyíu por 14 protones y 7 electrones.[1]
El modelu de Rutherford funcionó abondo bien mientres munchos años. Pensábase que la repulsión de les cargues positives ente protones yera arreglada polos electrones (con carga negativa) interpuestos ordenadamente en mediu, polo que l'electrón yera consideráu como un "cementu nuclear".[1] Esto foi hasta que los estudios llevaos a cabu por Franco Rasetti, nel Institute of Technology de California en 1929. En 1925 sabíase que los protones y electrones tien un espín de 1 / 2, y nel modelu de Rutherford nitróxenu - 14 los 14 protones y seis de los electrones tendríen d'atayar les sos contribuciones al espín total, envalorándose un espín total de 1 / 2. Rasetti descubiertu, sicasí, que'l nitróxenu - 14 tien un espín total unidá.[2]
En 1930 Wolfgang Pauli nun pudo asistir a una xunta en Tubinga, y nel so llugar unvió una carta famosu cola clásica introducción "Queríos Señores y señores radiactivos ". Na so carta Pauli suxurió que seique esistía una tercer partícula nel nucleu, que la bautizó col nome de "neutrones". Suxurió que yera más llixeru qu'un electrón y ensin carga llétrica, y que nun interactuaba fácilmente cola materia (y por eso inda nun se-y detectara). Esta hipótesis dexaba resolver tanto'l problema del caltenimientu de la enerxía na desintegración beta y el espín de nitróxenu - 14, la primera porque los neutrones llevaben la enerxía ensin detectar y el segundu porque un electrón extra acoplar col electrón sobrante nel nucleu de nitróxenu - 14 p'apurrir un espín de 1. Enrico Fermi redenominó en 1931 los neutrones de Pauli como neutrinos (n'italianu pequeñu neutral) y unos trenta años dempués demostróse finalmente qu'un neutrinos realmente emítense na escayencia beta.
En 1932 James Chadwick diose cuenta de que la radiación que de que fuera reparáu por Walther Bothe, Herbert L. Becker, Irène y Jean Frédéric Joliot-Curie yera en realidá por cuenta de una partícula qu'él llamó'l neutrón. Nel mesmu añu Dimitri Ivanenko suxurió que los neutrones yeren, de fechu partícules de espín 1 / 2, qu'esistíen nel nucleu y que nun esisten electrones nel mesmu, y Francis Perrin suxurió que los neutrinos son partícules nucleares, que se crean mientres la escayencia beta. Fermi publicó 1934 una teoría de los neutrinos con una sólida base teórica. Nel mesmu añu Hideki Yukawa propunxo la primer teoría importante de la fuercia pa esplicar la forma en que'l nucleu caltién xuntu.
Depués del descubrimientu del neutrón, por James Chadwick, Werner Heisenberg (qu'enunció años antes el principiu d'incertidume), indicó que los neutrones pueden ser parte del nucleu, y non asina los electrones. Con esta teoría resolvíase totalmente el problema del spin que nun coincidía, amás d'esplicar tolos aspeutos del comportamientu nuclear.[2]
Sicasí, la nueva teoría traía consigo otru severu problema: col modelu anterior, qu'incluyía electrones como «cementu nuclear», esplicábase que los protones, toos cola mesma carga positiva, permanecieren totalmente xuntos, ensin que salieren disparaos pola repulsión de cargues iguales. Sicasí, col modelu qu'inclúi'l neutrón, nun había esplicación dalguna al respective de la forma en qu'en nucleu se caltién xuníu y nun esplota de momentu (esto ye, nengún elementu tendría d'esistir, cola única esceición del hidróxenu). Pa ejemplificar, la fuercia cola que se repelen dos protones a la distancia que tán (una diezbillonésima de centímetru), ye d'aproximao 240 newtons, fuercia abondo p'alzar nel aire un oxetu de daqué más de 24 quilogramos (nótese la enormidá inimaxinable d'esa fuercia yá que tamos falando de dos protones, que la so masa ye de daqué más de 10-27 quilogramos)[3]
La enorme dificultá que sufría la teoría foise resolviendo gradualmente. En 1927, Heisenberg propunxo'l principiu d'incertidume, qu'indica que mientres mayor sía la precisión con que conozamos la velocidá d'una partícula, con menor precisión vamos poder conocer la so posición.[4]
En 1930 Einstein dedució a partir d'esti principiu, per medios matemáticos, que si'l principiu ye correutu, tamién ye correutu otru tipu d'indetermín sobre la midida de la enerxía esistente nun sistema zarráu. Mientres menor sía'l ralu de tiempu nel cual quier sabese la cantidá d'enerxía del sistema, con menor precisión podrá midir.[3]
Al momentu de suxurir el modelu de nucleu protón-neutrón, en 1932, Heisenberg suxurió tamién la esistencia d'un campu de fuercia que xunía los protones, per mediu de la esistencia efímera d'una partícula. La esistencia d'esta partícula sería posible solo pol principiu d'incertidume, na versión enunciada por Einstein.[5]
El físicu xaponés, Hideki Yukawa, entós púnxose a analizar les propiedaes de la partícula propuesta por Heisenberg, y en 1935 describió eses propiedaes con precisión. La partícula solo podría esistir un intre d'unos Plantía:Notación científica segundos, tiempu abondu por que pueda dir d'un protón a otru, pero non más allá del nucleu del átomu. La enerxía necesaria pa la esistencia d'esta partícula nesi curtiu periodu afaise de primeres d'incertidume na versión d'Einstein.[5] Utilizando eses ecuaciones, la enerxía disponible nesi periodu sería de 20 pJ (picu xulios, Plantía:Notación científica o Plantía:Notación científica), lo qu'equival a una partícula con una masa de 250 vegaes la del electrón.
Dende entós hubo dellos intentos de detectar esa partícula esperimentalmente. De xacíu que siendo una partícula que solo esiste un curtiu intre, y utilizando enerxía non disponible, solo gracies de primeres d'incertidume, sería imposible de detectar, sacante si esa enerxía fora proporcionada. Los rayos cósmicos —partícules que lleguen del espaciu a enormes velocidaes— pueden apurrir esa enerxía. En 1948, esperimentando con rayos cósmicos en Bolivia, Cecil Frank Powell deteutó la partícula, que foi llamada Pion.[6]
Descripción del nucleu[editar | editar la fonte]
Forma y tamañu del nucleu[editar | editar la fonte]
Los nucleos atómicos son muncho más pequeños que'l tamañu típicu d'un átomu (ente 10 000 y 100 000 vegaes más pequeños). Amás contienen más del 99% de la masa colo cual la densidá másica del nucleu ye bien elevada. Los nucleos atómicos tienen dalgún tipu d'estructura interna, por casu los neutrones y protones paecen tar orbitando unos alredor de los otros, fechu que se manifiesta na esistencia del momentu magnéticu nuclear. Sicasí, los esperimentos revelen que'l nucleu paezse enforma a una esfera o elipsoide compactu de 10-15 m (= 1 fm), nel que la densidá paez práuticamente constante. Naturalmente'l radiu varia según el númberu de protones y neutrones, siendo los nucleos más pesaos y con más partícules daqué más grandes. La siguiente fórmula da'l radiu del nucleu en función del númberu de nucleones A:
Onde
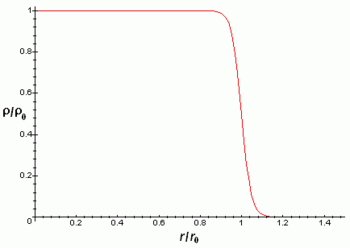
La densidá de carga llétrica del nucleu ye aproximao constante hasta la distancia y depués aparra rápido hasta práuticamente 0 nuna distancia acordies cola fórmula:
Onde r ye la distancia radial al centru del nucleu atómicu.
Los aproximamientos anteriores son meyores pa nucleos esféricos, anque la mayoría de nucleos nun paecen ser esféricos como revela que tengan momentu cuadrupolar distintu de cero. Esti momentu cuadrupolar manifestar na estructura hiperfina de los espectro atómicos y fai que'l campu llétrico del nucleu nun sía un campu coulombiano con simetría esférica.
Estabilidá del nucleu[editar | editar la fonte]
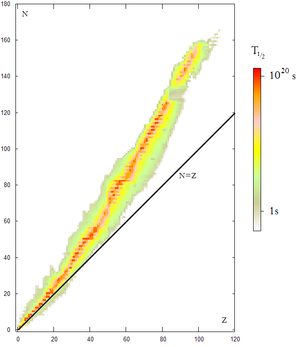
Los nucleos atómicos pórtense como partícules compuestes a enerxíes abondo baxes. Amás, la mayoría de nucleos atómicos per debaxo d'un ciertu pesu atómicu y qu'amás presenten un equilibriu ente'l númberu de neutrones y el númberu de protones (númberu atómicu) son estables. Sicasí, sabemos que los neutrones aisllaos y los nucleos con demasiaos neutrones (o demasiaos protones) son inestables o radiactivos.
La esplicación d'esta estabilidá de los nucleos mora na esistencia de los piones. Aislladamente los neutrones pueden sufrir vía interacción débil la siguiente desintegración:
(1)
Sicasí, dientro del nucleu atómicu la cercanía ente neutrones y protones fai que sían muncho más rápides, vía interacción fuerte les reacciones:
(2)
Esto fai que de cutio los neutrones del nucleu tresformar en protones, y dellos protones en neutrones, esto fai que la reacción () apenes tenga tiempu de soceder, lo qu'esplica que los neutrones de los nucleos atómicos sían muncho más estable que los neutrones aisllaos. Si'l númberu de protones y neutrones se desequilibra, ábrese la posibilidá de qu'en cada momentu haya más neutrones y sía más fácil l'escurrimientu de la reacción ().
Modelos d'estructura del nucleu atómicu[editar | editar la fonte]

En 1808 el químicu inglés John Dalton propón una nueva teoría sobre la constitución de la materia. Según Dalton tola materia ta formada por átomos indivisibles ya invisibles, estos de la mesma xúnense pa formar compuestos en proporciones enteres fixes y constantes. De fechu Dalton propunxo la esistencia de los átomos como una hipótesis pa esplicar porqué los átomos namái se combinaben en ciertes combinaciones concretes. L'estudiu d'eses combinaciones llevólu a poder calcular los pesos atómicos. Pa Dalton la esistencia del nucleu atómicu yera desconocida y considerábase que nun esistíen partes más pequeñes.
En 1897 Joseph John Thomson foi'l primeru en proponer un modelu estructural internu del átomu. Thomson foi'l primeru n'identificar l'electrón como partícula subatómica de carga negativa y concluyó que «si los átomos contienen partícules negatives y la materia presentar con neutralidá de carga, entós tienen d'esistir partícules positives». Ye según Thomson postuló que l'átomu tien de ser una esfera compacta positiva na cual atoparíense encuallaos los electrones en distintos llugares, de manera que la cantidá de carga negativa sía igual a la carga positiva.
Asina nin el modelu atómicu de Dalton nin el de Thomson incluyíen nenguna descripción del nucleu atómicu. La noción de nucleu atómicu surdió en 1911 cuando Ernest Rutherford y los sos collaboradores Hans Geiger y Ernest Marsden, utilizando un fexe de radiación alfa, bombardearon fueyes laminadas metáliques bien delgaes, asitiando una pantalla de sulfuru de cinc al so alredor, sustancia que tenía la cualidá de producir rellumos col choque de les partícules alfa incidentes. La fueya metálica foi travesada pola mayoría de les partícules alfa incidentes; dalgunes d'elles siguieron en llinia recta, otres fueron esviaes del so camín, y lo más sorprendente, bien poques rebotaron contra la llámina.
A la lluz de la fórmula dispersión usada por Rutherford:
(1)
Onde:
- , siendo la constante dieléctrica del vacíu y , ye la carga llétrica del centru dispersor.
- , ye la enerxía cinética inicial de la partícula alfa incidente.
- ye'l parámetru d'impautu.
Les resultancies del esperimentu riquíen parámetros d'impautu bien pequeños, y por tanto que'l nucleu tuviera concentráu na parte central, el nucleu de carga positiva, onde taría concentrada la masa del átomu. con ello esplicaba la esviación de les partícules alfa (partícules de carga positiva). Los electrones atopar nuna estructura esterna xirando n'órbites circulares bien alloñaes del nucleu, lo qu'esplicaría'l pasu mayoritariu de les partícules alfa al traviés de la llámina d'oru.
En 1913 Niels Bohr postula que los electrones xiren a grandes velocidaes alredor del nucleu atómicu. Los electrones disponer en diverses órbites circulares, que determinen distintos niveles d'enerxía. L'electrón puede aportar a un nivel d'enerxía cimera, pa lo cual precisa "absorber" enerxía. Pa volver al so nivel d'enerxía orixinal ye necesariu que l'electrón emita la enerxía absorbida (por casu en forma de radiación).
Comúnmente esisten dos modelos distintos describir el nucleu atómicu:
- El modelu de la gota d'agua *
El modelu de capes Anque dichos modelos son mutuamente escluyentes nes sos hipótesis básiques tal como fueron formulaos orixinalmente, A. Bohr y Mottelson construyeron un modelu mistu que combinaba fenomenológicamente carauterístiques de dambos modelos.
Modelu de la gota líquida[editar | editar la fonte]
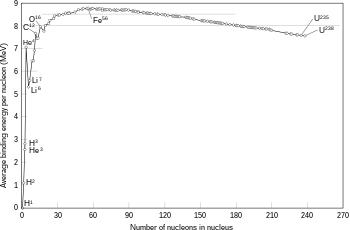
Esti modelu nun pretende describir la complexa estructura interna del nucleu sinón solo les enerxíes d'enllaz ente neutrones y protones según dellos aspeutos de los estaos escitaos d'un nucleu atómicu que se reflexen nos espectros nucleares. Foi primeramente propuestu por Bohr (1935) y el nucleu n'analoxía con una masa de fluyíu clásicu compuestu por neutrones y protones y una fuercia central coulombiana repulsiva proporcional al númberu de protones Z y con orixe nel centru de la gota.
Dende'l puntu de vista cuantitativu reparar que la masa d'un nucleu atómicu ye inferior a la masa de los componentes individuales (protones y neutrones) que lo formen. Esta non caltenimientu de la masa ta coneutada cola ecuación d'Einstein, pola cual parte de la masa ta en forma d'enerxía de trezu ente dichos componentes. Cuantitativamente tiense la siguiente ecuación:[7]
Onde:
- son respeutivamente la masa del nucleu, la masa d'un protón y la masa d'un neutrón.
- son respeutivamente el númberu atómicu (que coincide col númberu de protones), el númberu másico (que coincide col númberu de nucleones) y A-Z por tantu coincide col númberu de neturones.
- ye la enerxía d'enllaz ente tolos nucleones.
El modelu de la gota d'agua pretende describir la enerxía d'enllaz B a partir de considerancies xeométriques ya interpreta la enerxía de los estaos escitaos de los nucleos como rotaciones o vibraciones semiclásicas de la "gota d'agua" que representa'l nucleu. En concretu nesti modelu la enerxía d'enllaz represéntase como B:[8]
Onde:
- esti términu representa l'efectu favorable del volume.
- esti términu representa l'efectu desfavorable de la superficie.
- representa l'efectu de la repulsión coulombiana ente protones.
- representa'l fechu de que los nucleos "equilibraos" con un númberu similar de protones y neutrones son más estables.
- representa'l fechu de que los nucleos con un númberu par de protones y neutrones, son más estables que los que tienen un númberu impar de dambes especies. Matemáticamente el términu vien dau por:
Modelu de capes[editar | editar la fonte]
Esti ye un modelu que trata de prindar parte de la estructura interna reflexada tantu nel momentu angular del nucleu, como nel so momentu angular. Amás el modelu pretende esplicar porqué los nucleos con un "númberu máxicu" de nucleones (neutrones y protones) resulten más estables (los númberos máxicos son 2, 8, 20, 28, 50, 82 y 126).
La esplicación del modelu ye que los nucleones arrexuntar en "capes". Cada capa ta formada por un conxuntu d'estaos cuánticos con enerxíes similares, la diferencia d'enerxía ente dos capa ye grande comparada coles variaciones d'enerxía dientro de cada capa. Asina yá que los nucleones son fermiones un nucleu atómicu va tener les capes de menor enerxía llena polo que los nucleones nun pueden cayer a capes inferiores yá llenes. Les capes equí tienen d'entendese nun sentíu astractu y non como capes físiques como les capes d'una cebolla, de fechu la forma xeométrica del espaciu ocupáu por un nucleón nun determináu estáu d'una capa se interpenetra col espaciu ocupáu por nucleones d'otres capes, de manera análoga a como les capes electróniques se interpenetran nun átomu.
Ver tamién[editar | editar la fonte]
Bibliografía[editar | editar la fonte]
- Ensayo "De llombu del maestru" décimu tercer capítulu del llibru "L'electrón ye maniegu y otros ensayos"
- Ensayo "La certidumbre de la incertidume" décimu segundu capítulu del llibru "L'electrón ye maniegu y otros ensayos"
- C. Sánchez del Río (2003). C. Sánchez del Río editorial = Ediciones Pirámide: Física cuántica, páx. 882-899. ISBN 978-84-368-1656-3.
Referencies[editar | editar la fonte]
- ↑ 1,0 1,1 1,2 Asimov 1972, Aproximao nel sitiu 9,26% del ensayu (66,6% del llibru)
- ↑ 2,0 2,1 Asimov 1972, Aproximao nel sitiu 22,2% del ensayu (67,3% del llibru)
- ↑ 3,0 3,1 Asimov 1972, Aproximao nel sitiu 32,9% del ensayu (67,9% del llibru)
- ↑ Asimov 1972-b, Aproximao nel sitiu 38,9% del ensayu (62,8% del llibru)
- ↑ 5,0 5,1 Asimov 1972, Aproximao nel sitiu 72,8% del ensayu (70% del llibru)
- ↑ Asimov 1972, Aproximao nel sitiu 93,2% del ensayu (71,1% del llibru)
- ↑ C. Sánchez del Río, 2003, p. 893
- ↑ C. Sánchez del Río, 2003, p. 894

























