Vidru
| Vidru | |
|---|---|
|
estado no clásico de la materia (es) | |
 | |
El vidru[1] o vidriu[2] ye un material inorgánico duru, fráxil, tresparente y amorfu que s'atopa na naturaleza anque tamién puede ser producíu pol home. El vidru artificial usar pa faer ventanes, lentes, botelles y una gran variedá de productos. El vidru ye un tipu de material cerámico amorfu.
El vidru llograr por fusión a unos 1.500 °C d'óxidu de siliciu areno de xil (SiO2), carbonatu de sodiu (Na2CO3) y carbonatu de calciu caliar (CaCO3).
El términu "cristal" ye utilizáu bien frecuentemente como sinónimu de vidru, anque ye incorreutu nel ámbitu científicu por cuenta de que'l vidru ye un sólidu amorfu (les sos molécules nun tán dispuestes de forma regular) y non un sólidu cristalín.

Historia del vidru[editar | editar la fonte]


Los nuesos antepasaos usaben la obsidiana, un vidru natural, dende hai más de 75.000 años pa ellaborar cuchiellos y puntes de flecha.
El vidru na antigüedá[editar | editar la fonte]
Pliniu'l Vieyu (sieglu I), na so Historia Natural, cunta qu'unos mercaderes que se dirixíen escontra Exiptu pa vender natrón (carbonatu de sodiu), detener pa cenar a veres del ríu Belus, en Fenicia. Como nun había piedres p'asitiar les sos olles, decidieron utilizar dellos cachos de natrón. Calecieron los sos alimentos, comieron y dispunxéronse a dormir. A la mañana siguiente vieron ablucaos que les piedres fundiérense y reaccionaren col sable pa producir un material duro y brillante, el vidru.
En realidá, l'home aprendió a fabricar el vidru bien de tiempu enantes en forma d'esmaltes vitrificados, la fayenza. Hai cuentes de collares y restos de cerámica ellaboraos con fayenza en tumbes del periodu predinástico d'Exiptu, nes cultures Naqada (3500-3200 e.C.)[3]
Los primeros oxetos de vidru que se fabricaron fueron cuentes de collar o abalorios. Ye probable que fueren artesanos asiáticos los qu'establecieron la manufactura del vidru n'Exiptu, d'onde proceden les primeres vasíes producíes mientres el reináu de Tutmosis III (1504-1450 e.C.) La fabricación del vidru florió n'Exiptu y Mesopotamia hasta'l 1200 e.C. y darréu cesó casi por completu mientres dellos sieglos. Exiptu produció un vidru claru, que contenía xil pura; lo coloreaban d'azul y verde. Mientres la dómina helenística Exiptu convertir nel principal provisor d'oxetos de vidru de les cortes reales. Sicasí, foi nes mariñes fenicies onde se desenvolvió l'importante descubrimientu del vidru sopláu nel sieglu I e.C. Mientres la dómina romana la manufactura del vidru estender pol Imperiu, dende Roma hasta Alemaña.[4] Nesta dómina afayóse qu'añadiendo óxidu de manganesu podía esclariase el vidru.[5]
El vidru na Edá Media[editar | editar la fonte]
Nel norte d'Europa y Gran Bretaña siguieron produciendo oxetos utilitarios de vidru. El vidru común tipu Waldglas (del alemán, ‘vidru del monte') siguió fabricándose n'Europa hasta la era moderna. Sicasí, la producción más importante nesti material mientres la edá media fueron los mosaicos de vidru na Europa mediterránea y les vidreres na zona del norte. Los mosaicos facer con teseles de vidru, que se cortaben de bloques de vidru. En documentos del sieglu VI fai referencia a vidreres nes ilesies, anque los primeros exemplares calteníos daten del sieglu XI. Les más apreciaes ellaborar mientres los sieglos XIII y XIV, principalmente en Francia ya Inglaterra. El vidru se coloreaba o se laminaba yá coloriáu añadiendo óxidos metálicos al amiestu, y dempués cortábase. Los detalles pintaben sobre'l cristal con un esmalte. Les pieces suxetar con banielles de plomu nuna estructura de fierro. L'arte de la fabricación de vidreres decayó a finales de la renacencia anque volvió recuperase nel sieglu XIX.[6]
El vidru nos países islámicos, ente los sieglos VIII y XIV, tuvo la so puxanza nel Oriente Próximu. L'antigua tradición Sasánida de talláu del vidru foi siguida polos artesanos musulmanes que realizaron vasíes decoraes en alturrelieve, munches con motivos animales, y con vidru incoloru de gran calidá con diseños tallaos a la rueda. La téunica d'esmaltáu al fueu y la del doráu amontaron les posibilidaes decoratives, destacando los artesanos vidreros de Alepo y Damascu. D'Exiptu provién el descubrimientu de coloraciones vidraes con brillosos efeutos metálicos, tantu en cerámica como en vidru. Les llámpares de les mezquites y otres vasíes d'usu cotidianu pintar con motivos xeométricos propios del islam. Les sos formes y decoraciones influyeron na producción occidental posterior, destacando les de Venecia y España.[7]
De la renacencia al sieglu XVIII[editar | editar la fonte]
- El cristal venecianu El
cristal venecianu» más antiguu conocíu data del sieglu XV, anque'l vidru yá se fabricaba en Venecia dende'l sieglu X. Con centru na islla de Murano, los venecianos apoderaron el mercáu européu hasta l'añu 1700. La contribución más importante foi la ellaboración d'un vidru sódicu duru y refináu bien dúctil. Conocíu como «cristallo», yera incoloru, de gran tresparencia, bien asemeyada al cristal de roca. Tamién se faíen en cristal coloriáu y opacu. Escontra finales del sieglu XVI les vasíes fixéronse más llixeres y delicaes. Desenvolvieron un tipu de filigrana de vidru que sería bien asonsañada. Consistía n'incorporar hebras de vidru blancu opacu dientro d'un cristal tresparente, que producía l'efeutu d'un encaxe.
Tamién en Murano surdieron munchos estilos distintos pa llámpares de cristal, anque foi la factoría de Nevers, en Francia, la qu'adquirió mayor fama mientres el sieglu XVII. La práutica del grabáu al diamante, téunica de los artesanos holandeses del sieglu XVII, llograba ellaboraos diseños.
Los fabricantes de vidru d'Europa intentaron copiar les téuniques y decoraciones de los venecianos. La información espublizar col llibru L'arte del vidru (1612) d'Antonio Neri, y tamién polos sopladores de vidru venecianos, pos anque una llei prohibía a los artesanos vidreros abandonar Venecia y sopelexar los secretos del so arte, munchos instaláronse n'otros países europeos. Cada país desenvolvió les sos imitaciones. La influencia italiana tornó nel sieglu XVII, al surdir n'Alemaña ya Inglaterra nuevos métodos pa la fabricación de vidru.[8]
Estáu vitreu[editar | editar la fonte]
Tradicionalmente consideróse que la materia podía presentase baxu trés formes: la sólida, la líquida y la gaseosa. Nuevos medios d'investigación de la so estructura íntima –particularmente mientres el sieglu XX– punxeron al descubiertu otres formes o estaos nos que la materia puede presentase. Por exemplu l'estáu mesomorfo (una forma líquida coles sos fases esmécticas, nemáticas y colestéricas), l'estáu de plasma (o estáu plasmático, propiu de gases ionizados a bien altes temperatures) o l'estáu vitreu, ente otros.
Los cuerpos en estáu vitreu carauterizar por presentar un aspeutu sólidu con cierta durez y rixidez y qu'ante esfuerzo esternos moderaos se deforman de manera xeneralmente elástica. Sicasí, al igual que los líquidos, estos cuerpos son ópticamente isótopos, tresparentes a la mayor parte del espectru electromagnéticu de radiación visible. Cuando s'estudia la so estructura interna al traviés de medios como la difracción de rayos X, da llugar a bandes de difracción difuses similares a les de los líquidos. Si calécense, el so mafa va menguando pasu ente pasu –como la mayor parte de los líquidos- hasta algamar valores que dexen la so deformación so l'acción de la gravedá, y por casu tomar la forma del recipiente que los contién como verdaderos líquidos. Sicasí, nun presenten un puntu claramente marcáu de transición ente l'estáu sólidu y el líquidu o "puntu de fusión".
Toes estes propiedaes llevaron a dellos investigadores a definir l'estáu vitreu non como un estáu de la materia distinto, sinón a cencielles como'l d'un líquidu subenfriado o líquidu con una mafa tan alta que-y confier aspeutu de sólidu ensin selo. Esta hipótesis implica la considerancia del estáu vitreu como un estáu metaestable al qu'una enerxía d'activación abonda de les sos partícules tendría de conducir al so estáu d'equilibriu, esto ye, el de sólidu cristalín.

En sofitu d'esta hipótesis aduzse'l fechu esperimental de que, calecíu un cuerpu n'estáu vitreu hasta llograr un comportamientu claramente líquidu (a una temperatura abondo alzada por que la so mafa sía inferior a los 500 poises, por casu), si esfrezse lenta y curioso, apurriéndo-y al empar la enerxía d'activación necesaria pa la formación de los primeros corpúsculos sólidos (llantadera de microcristales, presencia de superficies activadores, catalizadores de nucleación, etc.) suel solidificarse dando llugar a la formación de conxuntos de verdaderos cristales sólidos.
Tou paez indicar que los cuerpos n'estáu vitreu nun presenten una ordenación interna determinada, como asocede colos sólidos cristalinos. Sicasí en munchos casos repara un desorde ordenáu, esto ye, la presencia de grupos ordenaos que se distribúin nel espaciu de manera total o parcialmente aleatoria.
Esto condució a distintos investigadores a plantegar diverses teoríes sobre la estructura interna del estáu vitreu, tantu de tipu xeométricu, basaes tantu nes teoríes atómiques como nes de tipu enerxéticu.
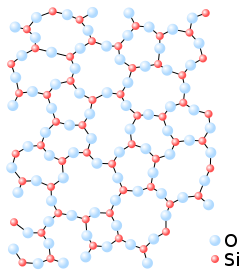
Según la teoría atómica xeométrica, nel xil sólidu cristalizáu l'átomu de siliciu tópase arrodiáu de cuatro átomos d'osíxenu asitiaos nos vértices d'un tetraedru cada unu de los cualos xúnelu a los átomos de siliciu vecín. Una vista en planta d'esti ordenamientu se esquematiza na figura 1, na que'l cuartu osíxenu taría enriba del planu de la páxina. Cuando esti xil pasa al estáu vitreu, la ordenación tetraédrica sigue calteniéndose a nivel individual de cada átomu de siliciu, anque los enllaces ente átomos d'osíxenu y siliciu realizar nun aparente desorde, que sicasí caltién una organización unitaria inicial (vease la figura 2).
Sicasí, nenguna d'estes teoríes ye abonda pa esplicar el comportamientu completu de los cuerpos vítreos anque pueden sirvir pa responder, en casos concretos y bien determinaos, a delles de les entrugues que se plantegen.
Les sustancies susceptibles de presentar un estáu vitreu pueden ser tantu de naturaleza inorgánica como orgánica, ente otres:
- Elementos químicos: Si, Se, Au-Si, Pt-Pd, Cu-Au.
- Óxidos: SiO2, B2O3, P2O5, y dalgunes de les sos combinaciones.
- Compuestos: As2S3, GeSe2, P2S3, BeF2, PbCl2, AgI, Ca(NON3)2.
- Silicones (sustancies consideraes como semiorgánicas)
- Polímeros orgánicos: tales como glicoles, azucres, poliamides, poliestirenos o polietilenos, etc.
Vidrios comunes[editar | editar la fonte]
Xil vítrea[editar | editar la fonte]
Denominar xil a un óxidu de siliciu de fórmula química SiO2. Presentar n'estáu sólidu cristalín baxu distintes formes enanciotrópicas. Les más conocíes son el cuarzu (la más frecuente y estable a temperatura ambiente), la cristobalita y les tridimitas. Amás d'estes formes, llegar a identificar hasta ventidós fases distintes, caúna d'elles estable a partir d'una temperatura perfectamente determinao.
Cuando se calecer el cuarzu amodo, este va pasando por distintes formes enanciotrópicas hasta algamar el so puntu de fusión a 1.723 °C. A esta temperatura llógrase un líquidu incoloro y bien mafosu que si s'esfrez con relativa rapidez, convertir nuna sustancia de naturaleza vítrea a la que se suel denominar vidru de cuarzu.
Esti vidru de cuarzu presenta un conxuntu de propiedaes de gran utilidá y d'aplicación en múltiples disciplines: na investigación científica, teunolóxica, na vida doméstica y polo xeneral en tou tipu d'industria. Destáquense como más relevantes les siguientes:
- Gran resistencia al ataque por axentes químicos, polo que ye bien utilizáu como material de llaboratoriu. Namái ye atacáu, de manera importante a temperatura ambiente, pol acedu fluorhídricu nes sos distintes formes (gaseosa o disolución). A temperatures cimeres a 800 °C reacciona a velocidaes apreciables con sales alcalinos o alcalinotérreassobremanera con sales sódicos, tales como'l carbonatu o'l sulfatu sódicos.
- Magar la so densidá a temperatura ambiente ye relativamente alta (2,2 g/cm³) el so coeficiente de dilatación llinial mediu a temperatures inferiores a los 1.000 °C ye desaxeradamente pequeñu: asitiar en 5,1•10-7 K-1, lo que dexa, por casu, calecer en candia y somorguialo sópito n'agua, ensin que se quebre. El númberu d'aplicaciones qu'esta propiedá amena ye eleváu.
- El so índiz de refraición a la radiación electromagnético visible ye 1,4589, lo que-y fai aptu pa preseos ópticos polo xeneral.
- La so resistividá llétrica ye del orde de los 1020 ohm·cm en condiciones normales lo que-y convierte n'unu de los meyores aislantes llétricos conocíos, con toles aplicaciones que d'ello se deriven na industria moderno.
- L'absorción de la radiación electromagnético del vidru de cuarzu amuesa una gran tresparencia a la lluz visible según nes bandes correspondientes al espectru ultravioleta, lo que-y fai especialmente aptu pa la fabricación de llámpares y otros preseos xeneradores d'esti tipu de radiación.
Otres propiedaes, sicasí, enzanquen la so ellaboración y usu. En particular, les siguientes:
| Temperatura | Mafa |
| °C | μ (poises) |
| 1.800 | 107,21 |
| 2.000 | 106,10 |
| 2.200 | 105,21 |
| 2.400 | 104,50 |
| 2.600 | 103,90 |
| 2.800 | 103,40 |
- El puntu de fusión del xil cristalizada depende de la variedá enanciotrópica que se trate. Pa la variedá estable a partir de los 1.470 °C (la α-cristobalita) esti ye de 1.723 °C. Estes son temperatures que nun pueden algamar fácilmente, salvu n'instalaciones bien especializaes. Por esta razón, la fabricación del vidru de cuarzu foi siempres rara y cara. Industrialmente, la so producción ye bastante llindada si comparar con otros tipos de vidru.
- El so mafa n'estáu vitreu presenta una gran variación cola temperatura, pasando de valores cimeros a 10⁷ poises (aspeutu totalmente sólidu) per debaxo de los 1.800 °C, a 103,5 poises a 2.758 °C (aspeutu pastosu y moldiable).
- Les mafes tomen valores tan por demás elevaos que tienen d'espresase como potencies de diez. Polo xeneral, les mafes de los vidrios suelen dase so la forma del so llogaritmu decimal. Pa llograr el vidru de cuarzu ye necesariu partir d'un cuarzu cristalizáu de gran pureza, finamente molíu, que se somete a altes temperatures. El líquidu que se llogra presenta gran cantidá de burbuyes diminutes d'aire ocluido ente los granos del cuarzu, que-y dan un aspeutu llechientu, tresllúcidu, al que se suel denominar gres de cuarzu y que les sos aplicaciones como recipiente resistente al ataque químicu o a los cambeos sópitos de temperatura son frecuentes. Sicasí, resulta totalmente inútil p'aplicaciones nes que se precise una gran tresparencia (llámpares de rayo UVA, llámpares de cuarzu y óptica polo xeneral). Pa estes postreres ye necesariu que mientres el procesu de fusión puedan esprendese eses burbuyes gaseoses ocluidas. Por que esi desprendimientu fuera efeutivu so la presión atmosférica y a una velocidá aplicable industrialmente, precisaríase que'l líquidu presentara una mafa per debaxo de los 200 poises, lo que nel casu del xil líquida implicaría temperatures del orde de los 3.600 °C. Na práutica pa poder desgasificar el vidru de xil fúndese'l cuarzu a temperatures próximes a los 2.000 °C en recipientes onde se fai'l vacíu, complicando enforma la teunoloxía de la so producción y, poro, encareciendo'l productu.
- La resistencia a la tracción n'estáu puru, en condiciones normales y con una superficie perfectamente llibre de toa fisura, ye d'unos 60 kbar. Esta gran resistencia (cimera a la del aceru) vese fuertemente menguada por imperfecciones na superficie del oxetu, por pequeñes qu'estes sían.
- El so módulu de Young a 25 °C ye de 720 kbar y el de torción 290 kbar. Cuando se-y somete a un esfuerciu de tracción mecánica a temperatures próximes a l'ambiente, pórtase como un cuerpu perfectamente elásticu con una función allargamientu/esforcio llinial, pero ensin práuticamente zona plástica cercana a la so llende de frayatu. Esta propiedá, xunida a la resistencia mecánica a la tracción enantes citada, convertir nun productu fráxil. Al cutilo, o se deforma elásticamente y la so forma nun s'alteria o, si devasar la so llende d'elasticidá, québrase.
Silicatu sódicu[editar | editar la fonte]
Los sales más comunes de sodiu tienen puntos de fusión per debaxo de los 900 °C. Cuando se calecer un amiestu íntimo de cuarzu finamente estremáu con un sal d'estos metales alcalinos, por casu Na2CO3, a una temperatura cimero a los 800 °C llógrase primeramente una fusión del sal alcalino, que'l so líquidu arrodia a los granos de cuarzu, produciéndose una serie de reacciones que pueden englobarse na resultante siguiente:
SiO2 (s) + Na2CO3 (s) Na2SiO3 (s) + CO2 (g) H = -5,12 kcal/mol
Esta reacción, llevemente exotérmica, esprende anhídridu carbónico gaseosu -que burbuya ente la masa en fusión- y conduz a un primer silicatu sódicu, de puntu de fusión 1.087 °C.
Acordies cola termodinámica, l'amiestu de dos sustancies de puntos de fusión distintes presenta un Puntu de Liquidus”[9] que s'asitia ente los de los dos sustancies en contautu. D'esta forma l'amiestu del xil y el silicatu sódicu formáu da llugar a un productu de SiO2 y silicatos, yá n'estáu líquidu a temperatures que nun devasen los 1.200 °C, lloñe de los más de 2.000 °C necesarios pa preparar el vidru de cuarzu.
Al productu asina llográu dáse-y corrientemente el nome xenéricu de silicatu sódicu, magar con esta denominación identificar a un conxuntu de productos derivaos de la fusión del cuarzu con sales sódicos (xeneralmente carbonatos) en distintes proporciones d'unu y otru componente. Industrialmente prepárense silicatos sódicos con proporciones molares de cada componente asitiaes ente:
- 3,90 moles de SiO2 / 1 mol de Na2O y 1,69 moles de SiO2 / 1 mol de Na2O ;
Nota: La proporción estequiométrica d'un metasilicato sódicu puru sería de 1 mol de SiO2 / 1 mol de Na2O
Estos silicatos sódicos presenten un aspeutu vitreu, tresparente y bien argayadizu. P'algamar una mafa del orde de los 1.000 poises (necesaria pal so moldiáu) precísense temperatures que, en función de la so composición, bazcuyen ente los 1.220 °C pal silicatu más ricu en SiO2, y los 900 °C pal más probe. Son bien solubles n'agua: ente un 35% y un 50% en pesu de silicatu, según el conteníu en SiO2. La so falta de rixidez mecánica y la so solubilidá n'agua fáen-yos inútiles como sustitutos del vidru de cuarzu en nenguna de les sos aplicaciones.
Raramente presentar na industria en forma sólida, sinón so la forma de disolución aguacienta. La so solución n'agua utilízase como pegamento cerámicu bien eficaz o como materia primo pa la producción per aciu hidrólisis de xel de xil, sustancia usada como absorbente del mugor (torres d'ensugáu de gases, etc.) o como componente de ciertos productos tales como neumáticos pa vehículos y otres aplicaciones na industria químico.
La so producción realizar en fornos continuos de balsa calecíos per aciu la combustión de derivaos del petroleu y frecuentemente tamién con enerxía llétrica, a temperatures lo más elevaes posibles (dientro d'una cierta rentabilidá) col fin d'aumentar la productividá del fornu. Estes temperatures suelen asitiase ente los 1.400 °C y los 1.500 °C.
Vidrios de silicatu sódicu[editar | editar la fonte]
Col fin de llograr un productu con propiedaes similares a les del vidru de cuarzu a temperatures algamables por medios téunicamente rentables, produzse un vidru de silicatu sódicu al que se-y añader otros componentes que-y faigan más resistente mecánicamente, inerte a los axentes químicos a temperatura ambiente -bien particularmente a l'agua- y que guarden la so tresparencia a la lluz, siquier nel espectru visible.
Estos componentes son metales alcalinotérreossobremanera magnesiu, calciu o bariu, amás d'aluminiu y otros elementos en menores cantidaes, dalgunos de los cualos apaecen apurríos como impureces poles materies primeres (casu del fierro, l'azufre o otros). Les materies primeres que s'utilicen pa la ellaboración de vidrios d'esti tipu escoyer ente aquelles que presenten un menor costu:
- Pal cuarzu:
- Arenas feldespáticas, de pureza en SiO2 superior al 95% y col menor conteníu en componentes férricos posible (ente un 0,15% y 0,01% en términos de Fe2O3)
- Cuarcites molíes
- Pal sodiu:
- Carbonatos sódicos naturales (xacimientos d'EE.XX. y África).
- Carbonatu sódicu sintéticu, el más utilizáu n'Europa.
- Sulfatu sódicu sintéticu, subproductu de la industria químico.
- Nitratu sódicu natural (nitratu de Chile).
- Cloruru sódicu o sal común.
- Estos trés últimos, utilizaos en pequeñes proporciones, debíu al desprendimientu de gases contaminantes mientres la ellaboración del vidru: SOX, NONX, Cl2.
- Pal Calciu:
- Caliares naturales.
- Pal Magnesiu:
- Dolomites naturales.
- Pal Bariu:
- Sulfatu bárico natural (baritina).
- Pal Aluminiu:
- Feldespatos naturales (caolinos).
La producción industrial d'esti tipu de vidrios realízase, al igual que nel casu de los silicatos sódicos, en fornos pa vidru, xeneralmente de balsa, calecíos per aciu la combustión de derivaos del petroleu con sofitu, en munchos casos, d'enerxía llétrica a temperatures que bazcuyen ente los 1.450 °C y los 1.600 °C. Nestos fornos introduz una amiestu en polvu llixeramente amugao (5% d'agua) y primeramente dosificada de les materies primeres yá citaes. Esti amiestu de materies minerales reacciona (a velocidaes apreciables y, evidentemente, cuanto mayores meyor) pa formar el conxuntu de silicatos que, combinaos y entemecíos, van dar llugar a esa sustancia a la que se denomina vidru común.
Propiedaes del vidru común[editar | editar la fonte]
Les propiedaes del vidru común, son una función tantu de la naturaleza como de les materies primeres como de la composición química del productu llográu. Esta composición química suelse representar en forma de porcentaxes en pesu de los óxidos más estables a temperatura ambiente de cada unu de los elementos químicos que lu formen. Les composiciones de los vidrios silicatu sódicos más utilizaos asítiense dientro de les llendes que s'establecen na tabla axunta.
| Componente | Dende ... % | ... hasta % |
| SiO2 | 68,0 | 74,5 |
| Al2O3 | 0,0 | 4,0 |
| Fe2O3 | 0,0 | 0,45 |
| CaO | 9,0 | 14,0 |
| MgO | 0,0 | 4,0 |
| Na2O | 10,0 | 16,0 |
| K2O | 0,0 | 4,0 |
| SO3 | 0,0 | 0,3 |
Munchos estudios –particularmente na primer metá del sieglu XX– intentaron establecer correlaciones ente lo que se denominó la estructura interna del vidru –xeneralmente basada en teoríes atómiques– y les propiedaes reparaes nos vidrios. Productu d'estos estudios fueron un conxuntu de rellaciones, de naturaleza absolutamente empírica, que representen de manera sorprendentemente precisa munches d'eses propiedaes per aciu rellaciones lliniales ente'l conteníu de los elementos químicos que formen un vidru determináu (espresáu so la forma del conteníu porcentual en pesu de los sos óxidos más estables) y la magnitú representando dicha propiedá. Curiosamente, les correlaciones coles composiciones espresaes en forma molar o atómica son muncho menos fiables.
| SiO2 | Al2O3 | Fe2O3 | CaO | MgO | Na2O | K2O | SO3 |
| 73,20 | 1,51 | 0,10 | 10,62 | 0,03 | 13,22 | 1,12 | 0,20 |
Los conteníos en MgO, Fe2O3 y SO3 son consecuencia de les impureces de la caliar, arena y el sulfatu sódicu, respeutivamente.
| Propiedá | Valor | Unidaes | Fonte |
| Densidá a 25 °C(1) | 2,49 | g/cm³ | Gilard & Dubrul |
| Coeficiente de dilatación llinial a 25 °C(2) | 8,72•10-6 | °C-1 | Wilkelman & Schott |
| Conductividá térmica a 25 °C | 0,002 | cal/cm.s.°C | Russ |
| Tensión superficial a 1200 °C | 319 | dinas/cm | Rubenstein |
| Índiz de refraición (a 589,3 nm)(3) | 1,52 | - | Gilard & Dubrul |
| Módulu d'elasticidá a 25 °C | 719 | kbar | Appen |
| Módulu de Poisson a 25 °C | 0,22 | - | Wilkelman & Schott |
| Resistencia a la tracción a 25 °C(4) | (900) | bar | Wilkelman & Schott |
| Constante dieléctrica (4.5.18⁸ Hz) | 7,3 | - | Appen & Bresker |
| Resistencia llétrica a 1100 °C | 1,06 | Ώ.cm | |
| Resistencia llétrica a 1500 °C | 0,51 | Ώ.cm | |
| Calor específico a 25 °C | 0,20 | cal/g/°C | Sharp & Ginter |
| Atacabilidad química DIN 12111(5) | 13,52 | ml de HCl 0,01N | R. Cuartes |
- Nota
- La mafa espresar na figura 3(6).
- Fonte
- Coeficientes pal cálculu de propiedaes del vidru (cuadru)

L'absorción (o tresparencia)(7) a la lluz de los vidrios de silicatu sódicu na zona del espectru visible (0,40 μ a 0,70 μ) depende del so conteníu n'elementos de transición (Nin y Fe nel exemplu). Sicasí, tantu nel ultravioleta como nel infrarroxu'l vidru pórtase práuticamente como un oxetu casi opacu, independientemente de cualesquier d'estos elementos.
- Notes
- (1) La densidá ye daqué más alzada que nel cuarzu fundíu 2,5 frente a 2,2 g/cm³).
- (2) El coeficiente de dilatación térmica llinial a temperatura ambiente, ye notablemente más altu que'l del xil fundida (unes 20 vegaes más), polo que los oxetos de vidrios de silicatu sódicu son menos resistentes al "choque térmicu".
- (3) El so índiz de refraición ye llixeramente mayor que'l del vidru de cuarzu y puede aumentar per aciu l'usu d'aditivos.
- (4) La resistencia a la tracción en cualquier tipu de vidru ye una magnitú que depende extraordinariamente del estáu de la superficie del oxetu en cuestión, polo que la so cuantificación ye complexa y pocu fiable.
- (5) La resistencia al ataque químicu o físicu (disolución) de los vidrios comunes ye una función de la so composición química fundamentalmente. Sicasí, en toos ellos esta resistencia ye alzada. Suelse midir per aciu una serie de pruebes tipificadas internacionalmente. Ente les más usaes:
- DIN 12116
- DIN 52322
- DIN 12111
- La atacabilidad de los vidrios tamién se modificar per aciu tratamientos superficiales: con SO2, Sn, Ti, y otros.
- (6) Pa moldiar un vidru ye necesaria una mafa que s'asitia ente 1.000 poises y 5.000 poises. Nel casu del xil son necesaries temperatures de más de 2.600 °C, en cuantes que pa los vidrios comunes basta con 1.200 °C, aproximao.
- (7) L'absorción de la lluz vese influyida pola estructura íntima d'estes materies tresparentes. Nel casu d'una estructura Si-O l'absorción de fotones ye baxa, inclusive pa llargores pequeños d'onda (tresparencia a los rayos UVA). Nun ye asina cuando a esta senciella estructura añader otros elementos (Na, Mg, Ca, etc.) qu'inciden decisivamente na absorción a los llonxitúes d'onda pequeñes (menores de 200 nm) y nes infrarroxes (cimeres a 700 nm). Per otra parte, la presencia na rede vítrea de elementos de transición (ver Tabla periódica de los elementos) produz absorciones selectives de radiación visible, lo que dexa, ente otres coses, colorear los vidrios con una amplia gama de matices.
Reciclaje del vidru[editar | editar la fonte]

El vidru ye un material totalmente reciclable y nun hai llende na cantidá de vegaes que puede ser reprocesado. Al reciclalo nun se pierden les propiedaes y afórrase una cantidá d'enerxía d'alredor del 30% con respectu al vidru nuevu.
Pal so fayadizu reciclaje el vidru ye separáu y clasificáu según el so tipu'l cual polo común ta acomuñáu al so color, una clasificación xeneral ye la qu'estrema a los vidrios en tres grupos: verde, ámbare o café y tresparente.

El procesu de recicláu dempués de la clasificación del vidru rique que tou material ayeno sía separáu como son tapes metáliques y etiquetes, depués el vidru ye esmagayáu y fundíu xunto con arena, hidróxidu de sodiu y caliar pa fabricar nuevos productos que van tener idéntiques propiedaes con respectu al vidru fabricáu direutamente de los recursos naturales.[11]
En delles ciudaes del mundu implementáronse programes de reciclaje de vidru, nelles pueden atopase contenedores especiales pa vidru en llugares públicos.
En ciertos casos el vidru ye reutilizáu, primero que recicláu. Nun se funde, sinón que se vuelve a utilizar namái llavándolo (nel casu de los recipientes). N'acristalamientos, tamién puede aprovechase el vidru cortándolo nuevamente (siempres que se precise una unidá más pequeña).
Ver tamién[editar | editar la fonte]
- Vidru del monte
- Vidru llexáu
- Vidru aislante
- Vidru armáu
- Vidru templáu
- Vidru laminado
- Vidru sopláu
- Vidru opalino
- Vidráu
- Cristal
Referencies[editar | editar la fonte]
- ↑ Esti términu apaez nel Diccionariu de l'Academia de la Llingua Asturiana. Ver: vidru
- ↑ Esti términu apaez nel Diccionariu de l'Academia de la Llingua Asturiana. Ver: vidriu
- ↑ Petrie Museum of Egyptian Archaeology. Period - Naqada II (3200BCE-3500BCE) UC5060
- ↑ Historia del Vidru, en saber.golwen.com.ar
- ↑ Bruce Nash. Modern Marvels: glass. History Channel.
- ↑ Historia del Vidru: El vidru na Edá Media, en saber.golwen.com.ar
- ↑ Historia del Vidru: El vidru nos países islámicos, en saber.golwen.com.ar
- ↑ Historia del Vidru: De la renacencia al sieglu XVIII, en saber.golwen.com.ar
- ↑ materiales industriales/material-de-clase-1/Tema5-Diagrames_de fase final.pdf Solubilidá total n'estáu sólidu (Diagrames d'equilibriu de fases). William F. Smith. Fundamentos de la Ciencia ya Inxeniería de Materiales. Tercer edición. Ed. Mc-Graw Hill Consultáu'l 10 d'ochobre de 2011.
- ↑ Coeficientes pal cálculu de propiedaes del vidru (cuadru)
- ↑ Reciclaje del vidru en Info Reciclaje
Enllaces esternos[editar | editar la fonte]



