Grafitu
Esti artículu o seición necesita referencies qu'apaezan nuna publicación acreitada, como revistes especializaes, monografíes, prensa diaria o páxines d'Internet fiables. |
| Grafitu | |
|---|---|
 | |
| Xeneral | |
| Categoría |
especie mineral (es) |
| Subclase de |
carbon-silicon family (en) |
| Fórmula química | C |
| Epónimu |
escribir (es) |
| Propiedaes físiques | |
| Color de la raya | negru |
| Durez de Mohs | 1,5 |
| Densidá absoluta | 2,16 g/cm³ |
| Entropía molar estándar | 55,74 J/(mol K)[3] |
| Clasificación | |
| Nickel-Strunz 8ª ed. | I/B.02a[4] |
| Nickel-Strunz 9ª ed. | 1.CB.05a[5] |
| Nickel-Strunz 10ª ed. | 1.CB.05a[6] |
| Dana | 1.3.6.2[5] |
El grafitu ye una de les formes alotrópicas nes que puede presentase el carbonu xunto al diamante, los fullerenos, los nanotubos y el grafeno. A presión atmosférica y temperatura ambiente ye más estable'l grafitu que'l diamante. Sicasí, la descomposición del diamante ye tan desaxeradamente lenta que namái ye apreciable a escala xeolóxica.
Foi nomáu por Abraham Gottlob Werner nel añu 1789. El términu grafitu deriva del griegu γραφειν (graphein) que significa "escribir", yá que s'usa principalmente pa crear la punta de los llapiceros. Tamién se denomina plombagina y plomu negru.
Puede estrayese de xacimientos naturales, pero tamién se produz artificialmente. El principal productor mundial de grafitu ye China, siguíu d'India y Brasil.
Estructura
[editar | editar la fonte]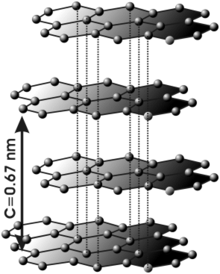
Nel grafitu los átomos de carbonu presenten hibridación sp², esto significa que forma trés enllaces covalentes nel mesmu planu a un ángulu de 120º (estructura hexagonal) y que un orbital Π perpendicular a esi planu quede llibre (estos orbitales deslocalizados son fundamentales pa definir el comportamientu llétricu del grafitu). L'enllaz covalente ente los átomos d'una capa ye desaxeradamente fuerte. Sicasí, les uniones ente les distintes capes realizar por fuercies de Van der Waals ya interacciones ente los orbitales Π, y son muncho más débiles.
Podría dicise que'l grafitu ta constituyíu por capes de grafeno superpuestes.
Esta estructura llaminar fai que'l grafitu seya un material marcadamente anisótropo.
Al igual que'l diamante, el grafitu ta constituyíu puramente por átomos de carbonu, pero con una estructura cristalina particular. Tanto'l grafitu como'l diamante son formes alotrópicas del carbonu, d'ente les múltiples que son posibles. El grafitu, como'l diamante, ye un mineral semimetálico. Conócense procesos por aciu los cualos el grafitu puede convertise en diamante por aciu l'usu de bien elevaes presiones y temperatures, pero esos métodos son d'un costu cimeru al valor de mercáu de los diamantes que se llograríen, polo que'l fechu apenes s'aprovechó comercialmente sacante pa fabricar microdiamantes emplegaos en ferramientes especiales.
Propiedaes
[editar | editar la fonte]El grafitu ye de color negru con rellumu metálicu, refractariu y s'exfolia con facilidá. Na direición perpendicular a les capes presenta una conductividá de la lletricidá baxa, qu'aumenta cola temperatura, portándose pos como un semiconductor. A lo llargo de les capes la conductividá ye mayor y aumenta proporcionalmente a la temperatura, portándose como un conductor semimetálico. Anque tanto'l grafitu como'l diamante tán formaos puramente por átomos de carbonu, el grafitu ye bien blandu y opacu, ente que'l diamante ye'l mineral más duru según la escala de Mohs y amás dexa pasar la lluz al traviés de sigo. Estes marcaes diferencies físiques débense puramente a les distintes redes cristalines o retículos sobre les que se disponen los átomos de carbonu nel grafitu (átomos de carbonu nos vértices de prismes hexagonales) y nel diamante (la rede cristalina ta fecha de tetraedros regulares que los sos vértices son átomos de carbonu).
Aplicaciones
[editar | editar la fonte]- El grafitu entemecíu con una pasta utilizar pa fabricar la mina de los llapiceros.
- Úsase como componente de lladriyos, crisoles, etc.
- Al esmucise les capes fácilmente nel grafitu, resulta ser un bon llubricante sólidu.
- Utilizar na fabricación de diverses pieces n'inxeniería, como pistones, xuntes, arandeles, rodamientos, etc.
- Por cuenta de la so conductividá llétrica usar pa fabricar electrodos. Tamién tien otres aplicaciones llétriques, como los carbones d'un motor (escobuques), qu'entren en contautu col colector.
- Emplegar en reactores nucleares, como moderadores y reflectores.
- Ye usáu pa crear discos de grafitu paecíos a los de disco vinilu salvu pol so mayor resistencia a movimientos sópitos de les aguyes llectores.
- Puede crease grafeno, material d'alta conductividá llétrica y térmica, futuru sustitutu del siliciu na fabricación de chips.
- Emplegar na fabricación de carretes y cañes de pesca.
== Compuestos d'intercalación de grafitu Distintes molécules o iones pueden enfusar nes capes del grafitu. Por casu el potasiu puede dexar un electrón al grafitu, quedando'l ion de potasiu, K, ente les capes. Esti electrón contribúi a aumentar la conductividá que presentaba'l carbonu.
Pueden preparar distintos compuestos d'intercalación con distintes estequiometrías y distintes especies. En dellos casos la conductividá resultante ye mayor, como nel casu del potasiu, y ye lo qu'asocede xeneralmente, pero n'otros, como por casu con flúor, ye menor.
Otres formes rellacionaes
[editar | editar la fonte]Esisten otres formes llamaes de carbón amorfo que tienen una estructura rellacionada cola del grafitu:
Referencies
[editar | editar la fonte]- ↑ Afirmao en: The IMA List of Minerals (March 2019). Autor: International Mineralogical Association - Commission on new minerals, nomenclature and classification. Data d'espublización: marzu 2019.
- ↑ NIOSH Pocket Guide ID: 0306.
- ↑ URL de la referencia: https://chem.libretexts.org/Bookshelves/General_Chemistry/Book%3A_ChemPRIME_(Moore_et_al.)/16%3A_Entropy_and_Spontaneous_Reactions/16.06%3A_Standard_Molar_Entropies. Data de consulta: 25 xineru 2019.
- ↑ Afirmao en: Mineralogische Tabellen : Eine Klassifizierung der Mineralien auf kristallchemischer Grundlage, mit einer Einfuhrung in die Kristallchemie (1982). Autor: Karl Hugo Strunz. Editorial: Akademische Verlagsgesellschaft. Data d'espublización: 1982.
- ↑ 5,0 5,1 Afirmao en: mineralienatlas.de. Llingua de la obra o nome: inglés.
- ↑ Afirmao en: MinDat. Llingua de la obra o nome: inglés.
Enllaces esternos
[editar | editar la fonte]
 Wikimedia Commons tien conteníu multimedia tocante a Grafitu.
Wikimedia Commons tien conteníu multimedia tocante a Grafitu.- El Grafitu.
- The Graphite Page (n'inglés).
- Web con muncha información sobre'l grafitu.
- Carbón.
