Diagrama de fase
Esti artículu o seición necesita referencies qu'apaezan nuna publicación acreitada, como revistes especializaes, monografíes, prensa diaria o páxines d'Internet fiables. |
En termodinámica y ciencia de materiales denominar diagrama de fase o diagrama d'estaos de la materia, a la representación ente distintes estaos de la materia, en función de variables escoyíes pa facilitar l'estudiu del mesmu.[1] Cuando nuna d'estes representaciones toles fases correspuenden a estaos d'agregamientu distintos suelse denominar diagrama de cambéu d'estáu.
Les diagrames d'equilibriu pueden tener distintes concentraciones de materiales que forma una aleación a distintes temperatures. Diches temperatures van dende la temperatura percima de la cual un material ta en fase líquida hasta la temperatura ambiente y en que xeneralmente los materiales tán n'estáu sólidu.
Distintes diagrames d'equilibriu[editar | editar la fonte]
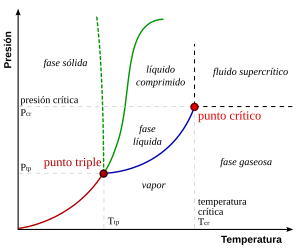
Estos son toos aquellos a los que les diagrames d'equilibriu mas senciellos son los de presión-temperatura esta ye una sustancia puro, como pue ser el de l'agua. Na exa d'ordenaes asítiase la presión y nel d'ascises la temperatura. Xeneralmente, pa una presión y temperatura dau, el cuerpu presenta una única fase sacante nes siguientes zones:
- Puntu triple: Nesti puntu de la diagrama coesisten los estaos sólidu, líquidu y gaseosu. Estos puntos tienen ciertu interés, yá que representen un invariante y polo tanto pueden utilizase pa cubicar termómetros.
Dos metales (A, B) a temperatures cimeres a los sos respeutivos puntos de fusión (TA, TB) atopar n'estáu líquidu pudiéndose eslleir y conformar asina una fase única líquida. Esto quier dicir que nun podemos establecer diferencies de comportamientu o observación ente les distintes partes del líquidu y que los metales nes proporciones entemecíes tienen la propiedá de miscibilidad. Si l'amiestu líquido, XA + XB, someter a un procesu de solidificación, por aciu enfriamientu, llegamos a llograr el productu que se denomina aleación de los metales A y B.
Ye conocíu que les aleaciones ameyoren les carauterístiques de los metales puros. Realmente tendría de dicise qu'introducen variables qu'estremen el comportamientu de los metales puros que les componen, porque en delles circunstancies pueden perxudicar les sos propiedaes. Obviamente, conformar una aleación ye unu de los medios más primitivos que la inxeniería dispunxo p'actuar sobre les propiedaes de los metales puros, inclusive históricamente l'aleación ye predecesora como lo xustifica'l bronce, Edá del bronce
En ciencia de materiales utilícense llargamente les diagrames de fase binarios, ente qu'en termodinámica empléguense sobremanera les diagrames de fase d'una sustancia puro.
Diagrama de fase d'una sustancia puro[editar | editar la fonte]
Esisten distintes diagrames según los materiales sían totalmente solubles n'estáu sólidu y líquidu o sían miscibles a que sían insolubles. Tamién pueden dase casos particulares. Unu de les diagrames d'equilibriu más clásicu ye'l de los aceros que tien particularidaes y onde afecta claramente la concentración y les distintes cristalizaciones que puede dase nel fierro tando n'estáu sólidu y a distintes temperatures.
- Los pares (presión, temperatura) que correspuenden a una transición de fase ente:
- Dos fases sólides: Cambéu alotrópico;
- Ente una fase sólida y una fase líquida: fusión - solidificación;
- Ente una fase sólida y una fase vapor (gas): sublimación - deposición (o sublimación inversa);
- Ente una fase líquida y una fase vapor: vaporización - condensación (o licuefacción).
Ye importante señalar que la curva que dixebra les fases vapor-líquidu detener nun puntu llamáu puntu críticu (La densidá del líquidu y vapor son iguales). Más allá d'esti puntu, la materia preséntase como un fluyíu supercrítico que tien propiedaes tantu de los líquidos como de los gases. Modificando la presión y temperatura en valores alredor del puntu críticu prodúcense reacciones que pueden tener interés industrial, como por casu les utilizaes pa llograr café escafeinao.
Ye precisu anotar que, na diagrama P-T de l'agua, la llinia que dixebra los estaos líquidu y sólidu tien rimada negativa, lo cual ye daqué abondo inusual. Esto quier dicir qu'aumentando la presión el xelu fúndese, y tamién que la fase sólida tien menor densidá que la fase líquida.
Diagrama de fase binariu[editar | editar la fonte]
Cuando apaecen delles sustancies, la representación de los cambeos de fase puede ser más complexa. Un casu particular, el más senciellu, correspuende a les diagrames de fase binarios. Agora les variables a tener en cuenta son la temperatura y la concentración, de normal en masa.
Hai puntu y llinies nestes diagrames importantes pa la so carauterización:
- Sólidu puru o solución sólida
- Amiestu de disoluciones sólides (eutéctica, eutectoide, peritéctica, peritectoide)
- Entemez sólidu - líquidu
- Namái líquidu, yá seya amiestu de líquidos inmiscibles (emulsión)o un líquidu dafechu homoxéneo.
- Entemez líquidu - gas
- Gas (vamos considerar siempres homoxéneu, trabayando con poques variaciones da altitú).
Nuna diagrama binariu pueden apaecer les siguientes rexones:
- Llinia de liquidus, percima de la cual solo esisten fases líquides.
- Llinia de solidus, per debaxo de la cual solo esisten fases sólides.
- Llinia eutéctica y eutectoide. Son llinies horizontales (isotermas) nes que tienen lugar transformación eutécticas y eutectoides, respeutivamente.
- Llinia de solvus, qu'indica les temperatures pa les cualos una disolución sólida (α) d'A y B dexa de ser soluble pa tresformase en dos disoluciones sólides (α) + (β) de distinta composición n'A y B.
- Concentraciones definíes, nes que tienen lugar transformación a temperatura constante:
- Eutéctica
- Eutectoide
- Peritéctica
- Peritectoide
- Monotéctica
- Monotectoide
- Sintéctica
- Catatéctica
Ver tamién[editar | editar la fonte]
- Diagrama PVT
- Estáu d'agregamientu de la materia
- Cambéu d'estáu
- Regla de les fases de Gibbs
- Transición de fase
Referencies[editar | editar la fonte]
- ↑ «Construcción d'una diagrama de fases». Ciencia Básica Esperimental pa estudiantes d'Inxeniería Química. Consultáu'l 28 de mayu de 2016.
Enllaces esternos[editar | editar la fonte]
 Wikimedia Commons tien conteníu multimedia tocante a Diagrama de fase.
Wikimedia Commons tien conteníu multimedia tocante a Diagrama de fase.
