Reaición acedu-base
Una reacción ácidu-base o reacción de neutralización ye una reacción química qu'asocede ente un ácidu y una base produciendo un sal y agua. La pallabra "sal" describe cualesquier compuestu iónicu que'l so catión provenga d'una base (Na+ del NaOH) y que'l so anión provenga d'un ácidu (Cl- del HCl). Les reacciones de neutralización son xeneralmente exotérmicas, lo que significa qu'esprenden enerxía en forma de calor. Suélse-yos llamar de neutralización porque al reaccionar un ácidu con una base, estos neutralicen les sos propiedaes mutuamente.
Esisten dellos conceutos qu'apurren definiciones alternatives pa los mecanismos de reacción arreyaos nestes reacciones, y la so aplicación en problemes en disolución rellacionaos con elles. La pallabra neutralización puede interpretase como aniquilación o como eliminación, lo cuál nun ta bien alloñáu a la realidá. Cuando un ácidu entemecer con una base dambes especies reaccionen en distintos graos que dependen en gran midida de les concentraciones y volúmenes del ácidu y la base a manera ilustrativa puede considerase la reacción d'un ácidu fuerte que s'entemez con una base débil, esta postrera va ser neutralizada dafechu, ente que va permanecer en disolución una porción del ácidu fuerte, dependiendo de les moles que reaccionaron cola base. Pueden considerase trés alternatives adicionales que surden del amiestu d'un ácidu con una base:
- Entemezse un ácidu Fuerte con una base fuerte: Cuando esto asocede, la especie que va quedar en disolución va ser la que tea en mayor cantidá respeuto de la otra.
- Entemezse un ácidu débil con una base fuerte: La disolución va ser básica, yá que va ser la base la que permaneza na reacción.
- Entemezse un ácidu débil con una base débil: Si esto asocede, l'acidez d'una disolución va depender de la constante d'acidez del ácidu débil y de les concentraciones tantu de la base como del ácidu.
A pesar de les diferencies nes definiciones, la so importancia poner de manifiestu nos distintos métodos d'analises, cuando s'aplica a reacciones acedu-base d'especies gaseosas o líquides, o cuando'l calter acedu o básicu pue ser daqué menos evidente. El primeru d'estos conceutos científicos d'ácidos y bases foi apurríu pol químicu francés Antoine Lavoisier, alredor de 1776.[1]
Teoríes acedu-base históriques[editar | editar la fonte]
Definición de Lavoisier[editar | editar la fonte]
Yá que la conocencia de Lavoisier de los acedos fuertes taba acutáu principalmente a los oxácidos, que tienden a contener átomos centrales nun altu estáu d'oxidación arrodiaos d'átomos d'osíxenu, tales como'l HNO3 y l'H2SO4, y yá que nun yera consciente de la verdadera composición de los acedos hidrácidos (HF, HCl, HBr, HI y otros), definió los ácidos en términos del “osíxenu” conteníu, qu'él llamó d'esta forma a partir de les pallabres griegues que signifiquen "formador d'ácidu" (del griegu οξυς (oxys) que significa "acedu" o "sosteníu" y γεινομαι (geinomai) que significa "niciar").
La definición de Lavoisier celebróse como una verdá absoluta mientres más de 30 años, hasta l'artículu de 1810 y posteriores conferencies al cargu de Sir Humphry Davy nes que demostró la falta d'osíxenu nel H2S, H2Te y los hidrácidos.
Definición de Liebig[editar | editar la fonte]
Esta definición foi propuesta por Liebig, aproximao en 1838,[2] sobre la base de la so estensa obra alrodiu de la composición química de los ácidos orgánicos. Esto acabó cola distinción doctrinal ente ácidos basaos nel osíxenu y ácidos basaos n'hidróxenu, empecipiada por Davy. Según Liebig, un ácidu ye una sustancia que contién hidróxenu que puede ser reemplazáu por un metal.[3] La definición de Liebig, inclusive siendo dafechu empírica, caltener n'usu mientres casi 50 años, hasta l'adopción de la definición de Arrhenius.[4]
Teoríes acedu-base[editar | editar la fonte]
Definición de Arrhenius[editar | editar la fonte]
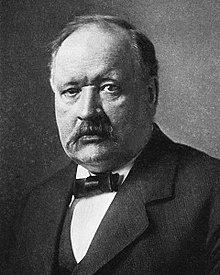
La definición de Arrhenius de les reacciones acedu-base ye un conceutu acedu-base más simplificáu, desenvueltu pol químicu suecu Svante Arrhenius, que foi utilizáu p'apurrir una definición más moderna de les bases que siguió al so trabayu con Friedrich Wilhelm Ostwald nel qu'establecíen la presencia d'iones en disolución aguacienta en 1884, y que llevó a Arrhenius a recibir el Premiu Nobel de Química en 1903 como "reconocencia de los sos estraordinarios servicios... emprestaos a la meyora de la química pola so teoría de la disociación electrolítica".[5]
Tal como se definió nel momentu del descubrimientu, les reacciones acedu-base carauterizar polos ácidos de Arrhenius, que se disocian en disolución aguacienta formando cationes hidróxenu (H+), reconocíos darréu como ion hidronio (H3O+),[5] y les bases de Arrhenius, que formen aniones hidroxilo (OH−). Más apocayá, los encamientos de la IUPAC suxurieron el términu de "oxonio" ,[6] en llugar del más antiguu y tamién aceptáu de "hidronio"[7] pa ilustrar los mecanismos de reacción ‒como los de les definiciones de Brønsted-Lowry y sistemes solventes‒ más claramente que cola definición de Arrhenius, qu'actúa como un simple esquema xeneral del calter acedu-base.[5] La definición de Arrhenius puede resumise como "los ácidos de Arrhenius, en disolución aguacienta, formen cationes hidróxenu, ente que les bases de Arrhenius formen aniones hidroxilo".
La tradicional definición aguacienta d'acedu-base del conceutu de Arrhenius descríbese como la formación d'agua a partir d'iones hidrógeno y hidroxilo, o bien como la formación d'iones hidrógeno y hidroxilo procedentes de la disociación d'un ácidu y una base en disolución aguacienta:
- H+ (aq) + OH− (aq)
 H2O
H2O
(Nos tiempos modernos, l'usu de H+ considérase como una abreviatura de H3O+, yá que anguaño sábese que'l protón aislláu H+ nun esiste como especie llibre en disolución aguacienta).
Esto conduz a la definición de que, nes reacciones acedu-base de Arrhenius, fórmase una sal y agua a partir de la reacción ente un ácidu y una base.[5] N'otres pallabres, ye una reacción de neutralización.
- acedu+ + base− → sal + agua
Los iones positivos procedentes d'una base formen un sal colos iones negativos procedentes d'un ácidu. Por casu, dos moles de la base hidróxidu de sodiu (NaOH) pueden combinase con un mol d'ácidu sulfúrico (H2SO4) pa formar dos moles d'agua y un mol de sulfatu de sodiu.
- 2 NaOH + H2SO4 → 2 H2O + Na2SO4
Definición de Bronsted-Lowry[editar | editar la fonte]
La definición de Brønsted-Lowry, formulada independientemente polos sos dos autores Johannes Nicolaus Brønsted y Thomas Martin Lowry en 1923, basar na idea de la protonación de les bases al traviés de la desprotonación de los ácidos, esto ye, la capacidá de los ácidos de "donar" cationes hidróxenu (H+) a les bases, quien de la mesma, los "acepten".[8] A diferencia de la definición de Arrhenius, la definición de Brønsted-Lowry nun se refier a la formación de sal y agua, sinón a la formación de ácidos conxugaos y bases conxugaes, producíes pola tresferencia d'un protón del ácidu a la base.[5][8]
Nesta definición, un "ácidu ye un compuestu que puede donar un protón, y una base ye un compuestu que puede recibir un protón". Arriendes d'ello, una reacción acedu-base ye la eliminación d'un catión hidróxenu del ácidu y el so adición a la base.[9] Esto nun se refier a la eliminación d'un protón del nucleu d'un átomu, lo que riquiría niveles d'enerxía non algamables al traviés de la simple disociación de los ácidos, sinón a la eliminación d'un catión hidróxenu (H+).
La eliminación d'un protón (catión hidróxenu) d'un ácidu produz el so base conxugada, que ye l'ácidu con un catión hidróxenu esaniciáu, y la receición d'un protón por una base produz la so ácidu conxugáu, que ye la base con un catión hidróxenu añadíu.
Por casu, la eliminación de H+ del ácidu clorhídrico (HCl) produz el anión cloruru (Cl−), base conxugada del ácidu::
- HCl → H+ + Cl−
La adición de H+ al anión hidróxidu (OH−), una base, produz agua (H2O), el so ácidu conxugáu:
- H+ + OH− → H2O
Asina, la definición de Brønsted-Lowry toma la definición de Arrhenius, pero tamién estiende'l conceutu de reacciones acedu-base a sistemes nos que nun hai agua arreyada, tales como la protonación del amoniacu, una base, pa formar el catión amoniu, el so ácidu conxugáu:
- H+ + NH3 → NH4+
Esta reacción puede asoceder n'ausencia d'agua, como na reacción del amoniacu col acedu acético:
- CH3COOH + NH3 → NH4+ + CH3COO−
Esta definición tamién apurre un marcu teóricu pa esplicar la disociación bonal de l'agua en baxes concentraciones d'iones hidronio ya hidróxidu:
- 2 H2O
 H3O+ + OH−
H3O+ + OH−
L'agua, al ser anfótera, puede actuar como un ácidu y como una base; equí, una molécula d'agua actúa como un ácidu, donando un catión H+ y formando la base conxugada, OH−, y una segunda molécula d'agua actúa como una base, aceptando'l catión H+ y formando l'ácidu conxugáu, H3O+.
Entós, la fórmula xeneral pa les reacciones acedu-base, acordies cola definición de Brønsted-Lowry, ye:
- AH + B → BH+ + A−
onde AH representa'l ácidu, B representa la base, y BH+ representa l'ácidu conxugáu de B, y A− representa la base conxugada de AH.
Definición de Lewis[editar | editar la fonte]
La definición de Lewis de les reacciones acedu-base, propuesta por Gilbert N. Lewis en 1923[10] ye amás, una xeneralización qu'entiende la definición de Brønsted-Lowry y les definiciones de sistema solvente.[11] En llugar de definir les reacciones acedu-base en términos de protones o d'otres sustancies enllazaes, la propuesta de Lewis define una base (llamada base de Lewis) como un compuestu que puede donar un Par d'electrones par electrónicu, y un ácidu (un ácidu de Lewis) como un compuestu que puede recibir dichu par electrónicu.[11]
Por casu, si consideramos la clásica reacción aguacienta acedu-base:
- HCl (aq) + NaOH (aq) → H2O (l) + NaCl (aq)
La definición de Lewis nun considera esta reacción como la formación d'un sal y agua o la tresferencia de H+ del HCl al OH−. Nel so llugar, considera como ácidu al propiu catión H+, y como base al anión OH−, que tien un par electrónicu non compartíu. Arriendes d'ello, equí la reacción acedu-base, acordies cola definición de Lewis, ye la donación del par electrónicu del anión OH− al catión H+, formándose un enllaz covalente Enllaz de coordinación coordináu o dativu ente H+ y OH−, que produz agua (H2O).
Al tratar les reacciones acedu-base en términos de pares d'electrones en cuenta de sustancies específiques, la definición de Lewis puede aplicase a reacciones que nun entren dientro de nenguna de les otres definiciones de reacciones acedu-base. Por casu, un catión plata pórtase como un ácidu con respectu al amoniacu, que se porta como una base, na siguiente reacción:
- Ag+ + 2:NH3
 [H3N:Ag:NH3]+
[H3N:Ag:NH3]+
La resultancia d'esta reacción ye la formación d'un aducto d'amoníaco-plata.
En reacciones ente acedos de Lewis y bases de Lewis, asocede la formación d'un aducto[11] cuando l'orbital molecular ocupáu más altu (HOMO) d'una molécula, tal como'l NH3, con pares d'electrones solitarios disponibles dona pares d'electrones llibres al orbital molecular más baxu ensin ocupar (LUMO) d'una molécula deficiente n'electrones, al traviés d'un enllaz covalente coordináu; en tal reacción, la molécula interactuante HOMO actúa como una base, y la molécula interactuante LUMO actúa como un ácidu.[11] En molécules altamente polares, como'l trifluoruro de boro (BF3),[11] l'elementu más electronegativu atrai los electrones escontra los sos propios orbitales, apurriendo una cierta carga positiva sobre l'elementu menos electronegativu y una diferencia na so estructura electrónica por cuenta de les posiciones de los sos electrones n'orbitales axiales o ecuatoriales, produciendo efeutos repulsivos de les interacciones "par solitariu-par enlazante" ente los átomos enllazaos por demás con aquellos provistos d'interacciones par enlazante-par enlazante.[11] Los aductos qu'arreyen iones metálicos conócense como compuestos de coordinación.[11]
Definición de sistema disolvente[editar | editar la fonte]
Esta definición basar nuna xeneralización de la definición anterior de Arrhenius a tolos disolventes autodisociables.
En toos estos disolventes, hai una cierta concentración d'especies positives, cationes solvonio, y especies negatives, aniones solvato, n'equilibriu coles molécules neutres del disolvente. Por casu, l'agua y el amoniacu se disocian n'iones oxonio y hidróxidu, y amoniu y amiduro, respeutivamente:
- 2 H2O
 H3O+ + OH−
H3O+ + OH− - 2 NH3
 NH4+ + NH2−
NH4+ + NH2−
Dellos sistemes apróticos tamién sufren estes disociaciones, tales como'l tetraóxido de dinitrógeno en nitrosonio y nitratu, y el tricloruro d'antimoniu, en dicloroantimonio y tetracloroantimoniato:
- N2O4
 NO+ + NO3−
NO+ + NO3− - 2 SbCl3
 SbCl2+ + SbCl4−
SbCl2+ + SbCl4−
Un soluto que causa un aumentu na concentración de los cationes solvonio y un amenorgamientu nos aniones solvato ye un ácidu, y unu que fai lo inverso ye una base. Arriendes d'ello, en amoniacu líquidu, el KNH2 (que suministra NH2-) ye una base fuerte, y el NH4NO3 (que suministra NH4+) ye un ácidu fuerte. En dióxidu d'azufre líquidu, los compuestos de tionilo (que suministren SO2+) pórtense como acedos, y los de sulfitos (que suministren SO32−) pórtense como bases.
Les reacciones acedu-base non aguacientes n'amoniacu líquido son similares a les reacciones n'agua:
- 2 NaNH2 (base) + Zn(NH2)2 (amida anfifílica) → Na2[Zn(NH2)4]
- 2 NH4I (ácidu) + Zn(NH2)2 (amida anfifílica) → [Zn(NH3)4)]I2
L'ácidu nítrico pue ser una base n'ácidu sulfúrico:
- HNO3 (base) + 2 H2SO4 → NO2+ + H3O+ + 2 HSO4−
Lo qu'estrema a esta definición amosar na descripción de les reacciones en disolventes apróticos, por casu,N2O4:
- AgNO3 (base) + NOCl (ácidu) → N2O4 + AgCl
Yá que la definición de sistema disolvente depende tantu del disolvente, como del compuestu mesmu, un mesmu compuestu puede camudar el so comportamientu dependiendo na eleición del disolvente. Asina, el HClO4 ye un ácidu fuerte n'agua, un ácidu débil en acedu acético, y una base débil en acedu fluorosulfónico.
Otres teoríes acedu-base[editar | editar la fonte]
Definición de Usanovich[editar | editar la fonte]
La definición más xeneral ye la del químicu rusu Mikhail Usanovich, y puede ser resumida como qu'un ácidu ye cualquier especie química qu'acepta especies negatives o dona especies positives, y una base lo inverso. Esto tiende a asolapase col conceutu de reacción redox (oxidación-amenorgamientu), polo que nun gocia del favor de los químicos. Esto debe a que les reacciones redox enfóquense meyor como procesos físicos de tresferencia electrónica, en llugar de procesos de formación y rotura d'enllaces, anque la distinción ente estos dos procesos ye difusa.
Definición de Lux-Flood[editar | editar la fonte]
Esta definición, propuesta pol químicu alemán Hermann Lux[12][13] en 1939, ameyorada darréu por Håkon Flood alredor de 1947[14] y agora usada comúnmente en xeoquímica y electroquímica modernes de sales fundíes, describe a un ácidu como un aceptor de aniones óxidu, y una base como un donante de aniones óxidu. Por casu:[15]
- MgO (base) + CO2 (ácid) → MgCO3
- CaO (base) + SiO2 (ácid) → CaSiO3
- NO—
3 (base) + S2O2-
7 (ácidu) → NO+
2 + 2 SO2-
4
Definición de Pearson[editar | editar la fonte]
En 1963[16] Ralph Pearson propunxo un conceutu cualitativu avanzáu conocíu como teoría acedu-base duru-blandiu desenvuelta darréu de forma cuantitativa con ayuda de Robert Parr en 1984. 'Duru' aplicar a especies que son pequeñes, tienen elevaos estaos d'oxidación, y son sele polarizables. 'Blandiu' aplicar a especies que son grandes, tienen baxos estaos d'oxidación, y son fuertemente polarizables. Los ácidos y les bases interactúan, y les interacciones más estables son los duru duru y blandiu-blandu. Esta teoría atopó usu en química orgánica ya inorgánica.
Importancia de les reacciones de neutralización como téuniques d'analises[editar | editar la fonte]
Esti tipu de reacciones son especialmente útiles como téuniques d'analís cuantitativu en analís volumétrico y conócense como valoraciones acedu-base. Nesti casu puede usase una disolución indicadora pa conocer el puntu nel que s'algamó la neutralización completa. Dellos indicadores son la fenolftaleína (si les sustancies reaccionantes son ácidu clorhídrico y hidróxidu de sodiu), azul de safranina, el azul de metileno, etc. Esisten tamién métodos electroquímicos pa llograr esti propósitu como l'usu d'un pH-metro o la conductimetría.
- Reacción de neutralización ente una base fuerte y un ácidu débil. El anión del ácidu sufre una hidrólisis produciéndose aniones hidróxidu, polo que'l pH ye > 7.
- Reacción de neutralización ente una base débil y un ácidu fuerte. El catión de la base sufre una hidrólisis produciéndose cationes hidronio, polo que'l pH ye < 7.
- Reacción de neutralización ente una base débil y un ácidu débil. El anión del ácidu sufre una hidrólisis al igual que'l catión de la base, polo que'l pH ye < 7 si ye más débil la base y ye >7 si ye más débil l'ácidu.
La eleición del indicador fayadizu pa determinar el puntu d'equivalencia va depender del pH final, que tien que tar dientro del intervalu nel que l'indicador sufre'l cambéu de color.
Exemplos:
Hidróxidu de sodiu con ácidu carbónico que forma carbonatu de sodiu y agua:
Acedu nítrico con hidróxidu d'aluminiu que forma nitratu d'aluminiu y agua:
Práutica de la neutralización[editar | editar la fonte]
Nun matraz Erlenmeyer ponemos una disolución d'ácidu clorhídrico y añadimos unes gotes del indicador fenolftaleína. La fenolftaleína ye un indicador qu'en mediu ácidu ye incoloru, ente qu'en mediu básicu adquier un color rosa, camudando de color ente pH 8 y 9,8. En principiu la disolución ye aceda ya incolora.
Agora asitiamos nuna bureta una disolución de hidróxidu de sodiu y abrimos la llave adulces. A midida que cai hidróxidu de sodiu, ésti va reaccionando col ácidu clorhídrico pa formar cloruru de sodiu y agua, colo que la concentración del ácidu mengua y el pH aumenta. Cuando se consumió tol ácidu, la siguiente gota de base que s'añader vuelve a la disolución básica, y l'indicador camuda al color rosa. Nesi momentu sabemos que tol ácidu foi neutralizáu.
Les neutralizaciones acedu-base prodúcense "equivalente a equivalente", esto ye, un equivalente d'ácidu ye dafechu neutralizáu por un equivalente de base.
Polo xeneral, la masa d'un equivalente gramu determinar teniendo en cuenta'l tipu de sustancia. Por casu nun ye lo mesmo el cálculu pa un ácidu que pa un sal. Amás hai que tener en cuenta'l tipu de reacción, yá que pudiera ser que la mesma sustancia actuando en reacciones distintes tuviera mases equivalentes distintes.
La masa d'un equivalente gramu d'un ácidu determinao ye igual a la masa molar d'esi ácidu estremada ente'l númberu de hidróxenos disociables del ácidu. Como los ácidos polipróticos se disocian per etapes pudiera ser que'l mesmu ácidu tuviera una masa del so equivalente gramu distinta dependiendo del númberu d'hidróxenos disociados na reacción del ácidu cola base.
La masa d'un equivalente gramu d'un hidróxidu, que suel ser el tipu de base más corriente, determinar estremando la masa molar del hidróxidu ente'l númberu de grupos OH– del hidróxidu.
La normalidá d'una disolución d'un ácidu determinar de la siguiente manera: Na (normalidá) = Ma (molaridad)/númberu d'hidróxenos.
La fórmula que dexa calcular el volume necesariu pa neutralizar un ácidu a partir d'una base vien dada pola espresión: Na · Va= Nb · Vb, siendo Na y Va la normalidá y el volume del ácidu y, como ye esperable, Nb y Vb la normalidá y el volume de la base, respeutivamente.
Si conocen trés de los datos anteriores puede determinase el cuartu. Por tanto si prepárase una disolución de concentración conocida de la base y añader ciertu volume conocíu d'esta a un erlenmeyer, podría determinase la normalidá del ácidu determinando nuna valoración el volume gastáu d'este pa neutralizar dafechu la base anterior.
P'aumentar la fiabilidá del valor de normalidá llográu repitir la valoración delles vegaes. El valor de la normalidá sería la media de les valoraciones llograes con una incertidume dada pol error absolutu cometíu en tomar de midíes.
Caso de llevar a cabu una valoración d'un ácidu menos fuerte que l'ácidu clorhídrico habría qu'escoyer el indicador fayadizu. Pa ello habría que saber primeramente'l sal que se formaría na valoración p'asina envalorar el pH de la hidrólisis del sal formáu na neutralización y usar l'indicador que la so zona de viraje meyor afacer a esi pH.
Ver tamién[editar | editar la fonte]
- Configuración electrónica
- Estructura de Lewis
- Estructura de resonancia
- Protonación y deprotonación
- Sustitución nucleofílica y reacción redox
- Valoración acedu-base
- Sal (química)
Referencies[editar | editar la fonte]
- ↑ Miessler, L. M., Tar, D. A., (1991) p166 - La tabla de descubrimientos atribúi a Antoine Lavoisier ser el primeru en publicar una teoría científica en rellación colos oxoácidos.
- ↑ Miessler, L. M., Tar, D. A., (1991) p166 - la tabla de descubrimientos atribúi a Justus von Liebig como fecha de publicación 1838
- ↑ Meyers, R. (2003) p156
- ↑ H. L. Finston and A. C. Rychtman, A New View of Current Acid-Base Theories, John Wiley & Sons, New York, 1982, páxs. 140-146.
- ↑ 5,0 5,1 5,2 5,3 5,4 Miessler, L. M., Tar, D. A., (1991) p165
- ↑ Murray, K. K., Boyd, R. K., et al. (2006) -- Téngase en cuenta que, nesti documentu, nun hai nenguna referencia a la desaprobación del términu "hidronio", que tamién permanez aceptáu, calteniéndose nel IUPAC Gold Book. Sicasí ponse de manifiestu la preferencia a utilizar el términu "oxonio"
- ↑ International Union of Pure and Applied Chemistry, et al. (2006), "Oxonium Ions"
- ↑ 8,0 8,1 Miessler, L. M., Tar, D. A., (1991), p167-169 -- Acordies colos autores, la definición orixinal yera que los "ácidos tienen enclín a perder un protón"
- ↑ Clayden, J., Warren, S., et al. (2000), p182-184
- ↑ Miessler, L. M., Tar, D. A., (1991) p166 - La tabla de descubrimientos atribúi la fecha de publicación de la teoría de Lewis como 1923.
- ↑ 11,0 11,1 11,2 11,3 11,4 11,5 11,6 Miessler, L. M., Tar, D. A., (1991) p170-172
- ↑ Franz, H. (1966), p4
- ↑ Lux, Hermann (1939). «"Säuren" und "Basen" im Schmelzfluss: die Bestimmung. der Sauerstoffionen-Konzentration». Ztschr. Elektrochem 45 (4): páxs. 303–309.
- ↑ Flood, Håkon; Forland, T. (1947). «The Acidic and Basic Properties of Aferruñes». Acta Chem. Scand. 1: páxs. 592. doi:.
- ↑ Drago, Russel S.; Whitten, Kenneth W. (1966). «The Synthesis of Oxyhalides Utilizing Fused-Salt Media». Inorg. Chem. 5 (4): páxs. 677–682. doi:.
- ↑ Pearson, Ralph G. (1963). «Hard and Soft Acids and Bases». J. Am. Chem. Soc. 85 (22): páxs. 3533–3539. doi:.
Bibliografía[editar | editar la fonte]
- Miessler, L. M., Tar, D. A., (1991) "Inorganic Chemistry" 2nd ed. Pearson Prentice-Hall
- Clayden, J., Warren, S., et al. (2000) "Organic Chemistry" Oxford University Press
- Meyers, R. (2003) "The Basics of Chemistry" Greenwood Press
- Lux, Hermann (1939). «"Säuren" und "Basen" im Schmelzfluss: die Bestimmung. der Sauerstoffionen-Konzentration». Ztschr. Elektrochem 45 (4): páxs. 303–309.
- Translated as: Lux, Hermann: “Acids” and “bases” in a fused salt bath: the determination of oxygen-ion. In: Journal of Electrochemistry, Vol 45 (1939), S. 303–309
- Drago, Russel S.; Whitten, Kenneth W. (1966). «The Synthesis of Oxyhalides Utilizing Fused-Salt Media». Inorg. Chem. 5 (4): páxs. 677–682. doi:.
- H. L. Finston and A. C. Rychtman, A New View of Current Acid-Base Theories, John Wiley & Sons, New York, 1982, páxs. 140-146.
- Franz, H. (1966). «Solubility of Water Vapor in Alkali Borate Melts». J. Am. Ceram. Soc. 49 (9): páxs. 473–477. doi:.
- International Union of Pure and Applied Chemistry (2006) IUPAC Compendium of Chemical Terminology, Electronic version Retrieved from International Union of Pure and Applied Chemistry on 9 May 2007 on URL http://goldbook.iupac.org/O04379.html
- Murray, K. K., Boyd, R. K., et al. (2006) "Standard definition of terms relating to mass spectrometry recommendations" International Union of Pure and Applied Chemistry.
Enllaces esternos[editar | editar la fonte]
- UC Berkeley video lecture on acid-base reactions
- Acid-base Physiology: an on-line text
- John W. Kimball's online Biology book section of acid and bases.
- Lavoisier, Davy, and Liebig theories at the ChemTeam Tutorials
- Tabla de constantes d'equilibrio Ka y Kb d'ácidos y bases.
&pg=PA1 Reaición acedu-base, p. 1, en Google Books


