Reaición de sustitución
Una reacción de sustitución ye aquella onde un átomu o grupu nun compuestu químicu ye sustituyíu por otru átomu o grupu.
Son procesos químicos onde les sustancies intervinientes, sufren cambeos na so estructura, pa dar orixe a otres sustancies. El cambéu ye más fácil ente sustancies líquides o gaseoses, o en disolución, por cuenta de que tópense más separaes y dexen un contautu más íntimu ente los cuerpos reaccionantes.
Química orgánica[editar | editar la fonte]
En química orgánica les sustituciones nucleófilas o electrófilas son bien importantes. Les reacciones de sustitución clasificar en distintos tipos según si'l reactivu que lleva a cabu la sustitución ye un nucléofilo, un electrófilo o un radical llibre o si'l sustratu ye alifático o arumosu. L'entendimientu detalláu de les distintes reacciones de sustitución ayuda a predicir el productu resultante. Esto amás dexa optimizar una reacción al respective de variables como la temperatura o la eleición del disolvente.
Halogenación radicalaria[editar | editar la fonte]
(Vease Halogenación)
- En alcanos:
- RH + X2 → RX + HX
Sustitución nucleófila[editar | editar la fonte]
- Nu- + CH3X → NuCH3 + X-
- (CH3)3CX → (CH3)3C+ + X- (Reacción d'equilibriu)
- (CH3)3C+ + Nu- → (CH3)3CNu
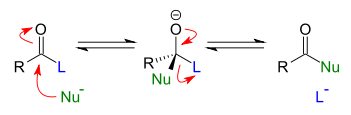
- Adición-eliminación en derivaos d'acedos carboxílicos (sustitución nucleófila acílica):
Sustitución electrófila arumosa[editar | editar la fonte]
Química de coordinación[editar | editar la fonte]
En química de coordinación nos complexos de los metales de transición en disolución tamién se producen reacciones de sustitución d'un amestando por otru:
- M-X + Y → M-Y + X
Onde X ye'l grupu saliente y Y el grupu entrante. Si'l grupu entrante mueve una molécula d'agua conozse como anación o anionización, y si ye al aviesu onde una molécula d'agua mueve a un amestando ye una hidrólisis o acuatización.
Según el so mecanismo les reacciones de sustitución d'amestando pueden ser de tipu:
- Disociativo (D), onde s'evidencia la esistencia d'un Entemediu de reacción entemediu con un númberu de coordinación inferior al complexu inicial. Tien llugar una previa disociadión del grupu saliente X siguida d'una coordinación col grupu entrante. Nesti casu la etapa determinante de la velocidá ye la disociación de X.
- [MLnX] → [MLn] + X (Reacción d'equilibriu)
- [MLn] + Y → [MLnY]
- Asociativu (A), onde se comprueba qu'esiste un entemediu con un númberu de coordinación cimera al complexu inicial. Nesti casu, primero tien llugar la coordinación del grupu entrante Y y finalmente la disociación del grupu saliente.La etapa limitante de la velocidá de reacción ye la formación del enllaz col grupu entrante Y.
- [MLnX] + Y → [MLnXY] → [MLnY] + X
- Intercambiu (I), onde nun esiste evidencia d'entemediu. Trátase d'un procesu alcordáu. Estremar ente intercambiu asociativu (Ia) si l'asociación va daqué per delantre de la formación de nuevos enllaces o disociativo (Id) si ye a la inversa.
Por tanto los dos primeros son mecanismos que tienen llugar en dos etapes y el segundu nuna sola.
Bibliografía[editar | editar la fonte]
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A.. ISBN 84-282-0882-4.
- A.G. Sharpe (1993). Química Inorgánica. Barcelona: Editorial Reverté, S.A.. ISBN 84-291-7501-6.
- D.F. Shriver, P.W. Atkins, C.H. Langford (1998). Química Inorgánica. Barcelona: Editorial Reverté, S.A.. ISBN 84-291-7006-5.