Historia de la química


La historia de la química toma un periodu de tiempu bien ampliu, que va dende la prehistoria hasta'l presente, y ta amestada al desenvolvimientu cultural del home y la so conocencia de la naturaleza. Les civilizaciones antigües yá usaben teunoloxíes que demostraben la so conocencia de los tresformamientos de la materia, y dalgunes sirviríen de base a los primeros estudios de la química. Ente elles cunten la estraición de los metales de los sos menas, la ellaboración d'aleaciones como'l bronce, la fabricación de cerámica, esmaltes y vidriu, les fermentación de la cerveza y del vinu, la estraición de sustancies de les plantes pa usales como medicines o arumes y el tresformamientu de les grases en xabón.
Nin la filosofía nin l'alquimia, la protociencia química, fueron capaces d'esplicar verazmente la naturaleza de la materia y los sos tresformamientos. Sicasí, a base de realizar esperimentos y rexistrar les sos resultaos los alquimistas establecieron los cimientos pa la química moderna. El puntu d'inflexón escontra la química moderna producir en 1661 cola obra de Robert Boyle, The Sceptical Chymist: or Chymico-Physical Doubts & Paradoxes (El químicu escépticu: o les duldes y paradoxes quimio-físiques), onde se dixebra claramente la química de la alquimia, abogando pola introducción del métodu científicu nos esperimentos químicos. Considérase que la química algamó'l rangu de ciencia de plenu derechu coles investigaciones d'Antoine Lavoisier, nes que basó la so llei de caltenimientu de la materia, ente otros descubrimientos qu'asitiaron les pilastres fundamentales de la química. A partir del sieglu XVIII la química adquier definitivamente les carauterístiques d'una ciencia esperimental moderna. Desenvolviéronse métodos de midida más precisos que dexaron una meyor conocencia de los fenómenos y desterráronse creencia ensin demostrar.
La historia de la química enxareyar cola historia de la física, como na teoría atómica y en particular cola termodinámica, dende los sos entamos con el mesmu Lavoisier, y especialmente al traviés de la obra de Willard Gibbs.[1]
Antecedentes[editar | editar la fonte]

La primera reaición química d'importancia que controlaron los humanos foi'l fueu. Hai restos dataos hai alredor de 500 000 años qu'atestigüen el dominiu del fueu,[2] siquier dende los tiempos del Homo erectus. Esti llogru considérase una de les teunoloxíes más importantes de la hestoria. Non solo apurría calor y lluz p'allumase, o sirvía pa estenar los montes o de proteición contra los animales selvaxes, sinón que foi la base pal control d'otres reaiciones químiques, como les derivaes de la cocción de los alimentos (que facilitaron la so dixestión y menguaben la cantidá de microorganismos patóxenos nellos) y más tarde de teunoloxíes más complexes como la cerámica, la fabricación de lladriyos, la metalurxa, el vidriu o la destilación d'arumes, medicines y otres sustancies conteníes nes plantes. Anque'l fueu fuera la primer reaición química usada de manera controlada, les cultures antigües desconocíen la so etioloxía. Mientres milenios consideróse una fuercia misterioso y mística capaz de tresformar unes sustancies n'otres produciendo lluz y calor. Al igual que se desconocíen les causes del restu de tresformamientos químicos, como les rellacionaes cola metalurxa, anque s'apoderaren les sos téuniques.
Metalurxa[editar | editar la fonte]
El primer metal emplegáu polos humanos foi'l oru que puede atopase en forma nativa, polo que nun precisa tresformamientos químicos. Atopáronse pequeñes cantidaes d'oru en delles cueves d'España usaes nel Paleolíticu cimeru aproximao fai 40 000 años.[3] La plata y el cobre tamién pueden atopase en forma nativa en pequeñes cantidaes (amás del estañu y el fierro meteóricu qu'apaecen en cantidaes exiguas) dexando un usu llindáu d'oxetos metalísticos nes cultures antigües.[4] Les téuniques d'esta metalurxa inicial llindar a fundir los metales cola ayuda del fueu pa purificarlos y dar forma a los adornos o ferramientes por aciu moldes o cincelado. Pero los metales nativos son escasos y l'usu d'oxetos metálicos nun se xeneralizó hasta que s'aprendió a estrayer los metales a partir de los sos minerales.
Metalurxa del bronce[editar | editar la fonte]

Dellos metales pueden llograse de los sos menas a cencielles caleciendo los minerales nuna pira, principalmente'l estañu y el plomu, y a mayores temperatures, nun fornu, el cobre; nun procesu d'amenorgamientu conocíu como fundición. Les primeres pruebes d'estraición metalúrxica proceden del xacimientu de Çatalhöyük n'Anatolia (Turquía), alredor 6400 e.C. ,[5] y los xacimientos arqueolóxicos de Majdanpek, Yarmovac y Plocnik, los trés en Serbia, dataos nos milenios V y VI e. C.. Tamién son notables les fundiciones de cobre atopaes nel xacimientu de Belovode,[6] con oxetos como un hachu de cobre del 5500 e.C. perteneciente a la cultura de Vinča.[7] Atopáronse más muertes de los primeros usos de los metales, dataos nel III mileniu e.C. , n'otros llugares como Palmela (Portugal), Los Millares (España) y Stonehenge (Reinu Xuníu).

De primeres los metales usar por separáu o entemecíos tal como s'atopaben. Al entemecese'l cobre con estañu o arsénicu intencionadamente consiguiéronse metales de meyores cualidaes, les aleaciones denominaes bronces. Con esta meyora teunolóxica surdió la Edá del Bronce. La teunoloxía rellacionada col bronce foi desenvuelta nel Oriente Próximu a finales del IV mileniu e.C. ,[8] fechándose n'Asia Menor antes del 3000 e.C. ; na antigua Grecia empezar a utilizar a mediaos del III mileniu e.C. ; n'Asia Central el bronce conocíase alredor del 2000 e.C. (n'Afganistán, Turkmenistán ya Irán), y pocu dempués llegaría a China, desenvolviéndose mientres la dinastía Shang. La Edá del Bronce non solo foi'l periodu de mayor desenvolvimientu de la metalurxa (en términos d'espansión y diversidá) sinón qu'influyó en munchos otros campos al estender l'usu d'oxetos metálicos. La disponibilidad de ferramientes y armes fabricaes con un metal más duru y resistente dexó'l desenvolvimientu de l'agricultura y los grandes exércitos, y fomentáronse les rutes comerciales pal intercambiu tantu de los minerales escasos como de productos terminaos. A partir de la Edá del Bronce los pueblos que consiguieron armes d'aleaciones y metales más duros imponer a los sos vecinos.
Metalurxa del fierro[editar | editar la fonte]
La estraición del fierro de los sos menas ye muncho más difícil que la del cobre y l'estañu, yá que rique un procesu de fundición más complexu, que precisa carbón (una fonte de CO) como axente reductor y mayores temperatures, pero a cambéu consíguese un metal más duro y aportunante que'l bronce, y muncho más abondosu. A diferencia de la producción del bronce que s'estendió pol Vieyu Mundu a partir d'un focu allugáu nel Oriente Próximu les téuniques de fundición del fierro podríen desenvolvese multipolarmente en distintes partes del mundu. Esisten restos arqueolóxicos con ferramientes fabricaes con fierro ensin níquel (prueba de que nun ye d'orixe meteóricu)[9][10] n'Anatolia alredor del 1800 e.C. ,[11][12] pero tamién s'atoparon ferramientes del periodu entendíu ente'l 1800 e.C. y 1200 e.C. nel valle del Ganges na India,[13] y en xacimientos n'África dataos alredor de 1200 e.C.[14][15][16] Les teunoloxíes siderúrxiques estender dende'l Mediterraneu escontra'l norte a partir del 1200 e.C. , llegando al norte d'Europa alredor del 600 e.C. , más o menos nes mesmes feches nes que llegaron a China.[17]
La mayoría de los métodos d'estraición y purificación de metales usaos na Antigüedá describir na obra de Pliniu'l Vieyu, Naturalis Historia. Amás de describir les téuniques intenta esplicar los métodos y fai observaciones bien precises sobre munchos minerales.

La cerámica y el vidriu[editar | editar la fonte]
Amás de la metalurxa l'usu del fueu apurrió a los humanos otres dos importantes teunoloxíes derivaes de tresformamientos físicu-químiques, la cerámica y el vidriu, que'l so desenvolvimientu acompañó al home dende la prehistoria hasta'l llaboratoriu modernu. Los oríxenes de la cerámica daten del Neolíticu cuando l'home afayó que los recipientes fechos de magre, camudaben les sos carauterístiques mecániques y amontaben la so resistencia frente al agua si yeren calecíos nel fueu. Pa controlar meyor el procesu desenvolviéronse distintos tipos de fornos, y cada cultura desenvolvió les sos propies téuniques y formes.
N'Exiptu afayóse qu'anubriendo la superficie con amiestos de determinaos minerales (sobremanera amiestos basaos nel feldespatu y la galena) la cerámica cubrir con una capa bien dura, menos porosa y brillante, l'esmalte, que'l so color poder camudar añadiendo pequeñes cantidaes d'otros minerales o variando les condiciones d'aireación del fornu. Estes teunoloxíes espublizáronse rápido. En China perfeccionáronse les teunoloxíes de fabricación de les cerámiques hasta dar cola porzolana nel sieglu VII. Mientres sieglos China caltuvo'l monopoliu na fabricación de la porzolana, y n'Europa desconocíase como fabricala hasta'l sieglu XVIII gracies a Johann Friedrich Böttger.
Rellacionáu col desenvolvimientu de la cerámica, apaez el desenvolvimientu del vidriu a partir del cuarzu y carbonatu de sodiu o carbonatu de potasiu. El so desenvolvimientu igualmente empezó nel Antiguu Exiptu y foi perfeccionáu polos romanos. La so producción masiva a finales del sieglu XVIII encamentó al gobiernu francés a premiar por aciu concursu un nuevu métodu pal llogru del carbonatu sódicu una y bones la fonte habitual (les cenices de madera) nun apurría cantidaes abondes como pa cubrir la creciente demanda. El ganador foi Nicolas Leblanc anque'l so procesu cayó en desusu en favor del procesu de Solvay, desenvueltu mediu sieglu más tarde, qu'impulsó descomanadamente'l desenvolvimientu de la industria químico.
Tresformamientos orgánicos de l'Antigüedá[editar | editar la fonte]
Les sociedaes antigües usaben un amenorgáu númberu de tresformamientos químicos naturales como les fermentación del vinu, la cerveza o la lleche. Tamién conocíen la tresformamientu del alcohol en vinagre, qu'usaben como conservante y condimento. Les pieles se curtían y blanquiaben somorguiándoles en orina aneya (que la so urea tresformar en amoniacu cuando s'almacena llargu tiempu) o soluciones de palomina (que contién ácidu úrico); y tamién s'usaba la so capacidá blanqueante coles manches persistentes de los texíos.[18] Amás teníen conocencia del procesu de saponificación; los primeros rexistros de fabricación de xabones daten de Babilonia alredor del 2800 e.C.[19]
Teoríes filosófiques de l'Antigüedá Clásica[editar | editar la fonte]

 fueu •
fueu •  tierra •
tierra •  aire •
aire •  agua
aguaen rellación coles sos propiedaes y los demás elementos.
Los filósofos intentaron racionalizar por qué les distintes sustancies teníen distintes propiedaes (color, durez, golor...), taben en distintos estaos (fluyíos o sólidos) y reaccionaben de distinta manera ante los cambeos del mediu, por casu frente a l'agua, el fueu o al ponese en contautu con otres sustancies. Estes observaciones impulsáron-yos a postular les primeres teoríes sobre la química y la naturaleza de la materia. Estes teoríes filosófiques relatives a la química pueden atopase en toles civilizaciones antigües. Un aspeutu común de toes elles yera l'intentu d'atopar un númberu amenorgáu d'elementos primarios que se combinaríen ente sigo pa formar toles demás sustancies de la naturaleza. Solíen tratase de sustancies conocíes como l'agua, la tierra, la madera o l'aire/vientu, y formes d'enerxía como'l fueu o la lluz, amás de conceutos astractos como'l éter o'l cielu. Delles civilizaciones distintes coincidieron en munchos d'estos conceutos, inclusive ente cultures ensin contautu, por casu los filósofos griegos, Historia de la India indios, Historia de China chinos y mayes consideraben que l'agua, la tierra y el fueu yeren elementos primarios, anque caúna d'estes cultures incluyía unu o dos elementos distintos más nel so propiu llistáu.
Na Grecia Clásica alredor del 420 e.C. Empédocles afirmó que tola materia taba formada por cuatro sustancies elementales: tierra, fueu, aire y agua. En sintonía con esta creencia la escuela hipocrática sostenía que'l cuerpu humanu taba formáu por cuatro humores. Darréu Aristóteles añadió a los cuatro elementos clásicos l'éter, la quintaesencia, razonando que'l fueu, la tierra, l'aire y l'agua yeren sustancies terrenales y corruptibles, y que como nun se percibíen cambeos nes rexones celestiales, les estrelles y planetes nun teníen de tar formaos por ellos sinón por una sustancia celestial ya inmutable.[20] Nes sos obres Física y Metafísica Aristóteles desenvuelve los sos conceutos duales de «sustancia y accidente», «esencia y forma», «actu y potencia» pa esplicar los cambeos de la naturaleza, incluyíes los tresformamientos de la materia. Les sos idees sobre la composición y tresformamientos de la materia, y el restu del funcionamientu de la naturaleza, convirtiéronse'l les predominantes tantu n'Occidente como n'Oriente Mediu, influyendo nes sos cultures mientres dos milenios.

Primeros atomistes[editar | editar la fonte]
Les teoríes iniciales sobre'l atomismu remontar a l'Antigua Grecia y la Historia de la India Antigua India.[21] L'atomismu griegu empecipiar colos filósofos Leucipo de Mileto y el so discípulu Demócrito alredor del 380 e.C. , que propunxeron que la materia taba compuesta por diminutes partícules indivisibles ya indestruyibles, denominaes por ello átomos (del griegu ἄτομος «ensin partes», «que nun s'estremen»). Afirmaciones similares fueron realizaes pol filósofu indiu Kanada nos sos testos de la escuela Vaisesika nun periodu cercanu.[21] Tamién los jainistas de la dómina teníen creencies atomistes.[21]
Alredor del 300 e.C. Epicuro postuló un universu formáu por átomos indestruyibles nel cual l'home tenía d'algamar l'equilibriu. El filósofu Lucrecio trató d'esplicar la filosofía epicúrea al públicu romanu na so obra del 50 e.C.,[22]De rerum natura (Sobre la naturaleza de les coses).[23] Nesta obra Lucrecio presenta los principios del atomismu, les teoríes sobre la naturaleza de la mente y l'alma, y esplicaciones pa los sentíos y el pensamientu, el desenvolvimientu del mundu y los fenómenos naturales.
Tanto los atomistes griegos y romanos como los de la India escarecíen de datos empíricos que sofitaren les sos creencies. Ensin estes pruebes, a los sos adversarios resultó-yos fácil negar les sos tesis. N'Occidente l'atomismu nunca consiguió formar parte de la opinión mayoritaria de la dómina. Aristóteles oponer a la esistencia de los átomos nel 330 e.C. y la so autoridá nel pensamientu occidental fizo que les idees atomistes quedaren retardaes mientres sieglos, hasta bien entrada la Edá Moderna.
Alquimia[editar | editar la fonte]

La alquimia (del árabe الخيمياء [al-khīmiyā]) ye una antigua práutica protocientífica y una disciplina filosófica que combinaba elementos de la química, la metalurxa, la física y la medicina cola astroloxía, la semioloxía, el misticismu y l'espiritualismu. La alquimia foi practicada en Mesopotamia, l'Antiguu Exiptu, Persia, l'Antigua Grecia, l'imperiu romanu, los califatos islámicos medievales y na India, China y Europa hasta'l sieglu XVIII, por una complexa diversidá d'escueles y sistemes filosóficos que tomaron siquier 2500 años.
La piedra filosofal y l'esoterismu[editar | editar la fonte]
L'alquimia defínese como la busca hermética de la piedra filosofal (una sustancia llexendario capaz de transmutar los metales n'oru o d'otorgar la inmortalidá y la omnisciencia), que'l so estudiu taba trescaláu de misticismu simbólicu y yera bien distintu de la ciencia moderna. Los alquimistas trabayaben pa faer tresformamientos a nivel esotéricu (espiritual) y exotérico (práuticu).[24] Estos aspeutos exotéricos protocientíficos de la alquimia fueron los que contribuyeron a la evolución de la química nel Exiptu grecorromanu, la Edá d'Oru del islam y dempués n'Europa. La alquimia y la química comparten el so interés pola composición y les propiedaes de la materia, y con anterioridá al sieglu XVIII nun había distinción ente dambes disciplines.[25]

La alquimia apurrió a la química la invención y desenvolvimientu de gran parte de la presea de llaboratoriu. Los primeres alquimistas occidentales, que vivieron nos primeros sieglos de nuesa yera, yá inventaron dellos equipamientos y procesos usaos darréu pola química. El bañu maría, o bañu d'agua pa calecer controladamente, lleva'l nome de María la Xudía considerada una de los fundadores de la alquimia. Nes sos obres tamién apaecen les primeres descripciones del tribikos (un tipu d'alambique de tres brazos) y del kerotakis (un dispositivu pa recoyer vapores).[26] Cleopatra la Alquimista describió los métodos de fundición y destilación de la dómina, dalgunos atribúyen-y la invención del primer alambique.[27] Cuando la disciplina desenvolver nel mundu islámicu, la infraestructura esperimental qu'estableció Jabir ibn Hayyan influyiría nos procedimientos de los demás alquimistas islámicos, y darréu n'Europa cuando se traducieron al llatín los sos testos.
Na so busca de la piedra filosofal los alquimistas afayaron y aprendieron a purificar munches sustancies químiques como'l alcohol, el amoniacu, la sosa cáustica, el vitriolo, l'ácidu muriático (clorhídricu), el acedu nítrico, el ácidu cítrico, el acedu acético, el ácidu fórmico, el arsénicu, el antimoniu, el bismutu y el fósforu, ente otres.
Elementos y metales de la alquimia[editar | editar la fonte]
El sistema d'elementos qu'usó l'alquimia medieval foi desenvueltu principalmente pol alquimista persa Jābir ibn Hayyān y enraigonábase na tradición de los elementos griegos de l'antigüedá clásica.[28] El so sistema constaba de los cuatro elementos de Empédocles y Aristóteles: aire, tierra, fueu y agua a los que s'añedir dos elementos filosóficos: el azufre, carauterizáu pol principiu de combustibilidad, «la piedra qu'ambura»; y el mercuriu que representaba les propiedaes metáliques. Estos postreros yeren consideraos polos primeres alquimistas como espresiones idealizaes de los componentes irreductibles del universu,[29] y fueron la principal contribución de l'alquimia filosófica.
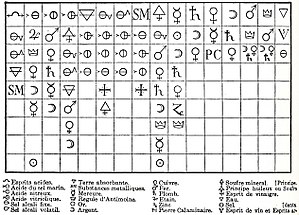
Na Edá Media n'Occidente esistía tradicionalmente una rellación ente la alquimia y l'astroloxía d'estilu greco-babilónicu. Nesa dómina conocíen siete metales (que salvo'l mercuriu nun se consideraben elementos) y tamién se conocíen siete astros en redol a la Tierra (yá que imperaba el xeocentrismu), polo que se rellacionaba cada metal y les sos propiedaes con un astru.[lower-alpha 1]La identificación ente dambos llegaba hasta'l puntu de que'l símbolu del planeta tamién s'usaba pa representar al metal. Les asociaciones yeren les siguientes:
Nos últimos sieglos de la edá media, en redol a 1250, Alberto Magno consiguió aisllar el arsénicu, anque los sos compuestos yeren yá conocíos dende l'antigüedá. Darréu'l alquimista suizu Paracelso influyíu pola alquimia musulmana amplió tamién a siete los elementos na so llista alternativa, añadiendo a los cuatro tradicionales tres elementos alquímicos adicionales, denominaos tría prima, tres principios metálicos pa representar les propiedaes de la materia: l'azufre pa la combustibilidad, el mercuriu pa la volatilidá y l'estabilidá, y el sal pa la solidez. Razonaba que los cuatro elementos de la teoría elemental aristotélica manifestar nos cuerpos como tres principios. Paracelso considerar principios fundamentales y esplicar recurriendo al exemplu de la madera amburando nel fueu. El mercuriu que yera'l principiu de la cohesión tenía de dise por que la madera descompunxérase, y como yera volátil esmorecer col fumu. El calor que s'esprendía coles llapaes provenía del azufre (la combustibilidad) y les cenices que quedaben yera'l sal qu'implicaba la solidez.[30]

Alquimia nel mundu islámicu[editar | editar la fonte]
Nel mundu islámicu siguióse la tradición clásica al traducise al árabe les obres de los antiguos griegos y exipcios y fueron la cultura más próspera en tolos ámbitos científicos de la dómina.[31] El desenvolvimientu del métodu científicu modernu foi lentu y progresivu, y el principiu del métodu científicu en química empezó ente los alquimistas musulmanes medievales, empecipiáu pol persa del sieglu IX, Jābir ibn Hayyān (conocíu como "Geber" n'Europa), que se considera unu de los padres de la química.[32][33][34][35] Él introdució un enfoque sistemático y esperimental a la investigación científica nel llaboratoriu, a diferencia de los antiguos griegos y exipcios que les sos obres basar en elucubraciones principalmente alegóriques y dacuando inintelixibles.[36][lower-alpha 3] Tamién inventó'l alambique tal como lo conocemos y de él procede'l so nome actual (al-anbiq), afayó y analizó munches sustancies químiques, estableció la distinción ente ácidos y álcalis, y fabricó cientos de medicines.[37] Amás redefinió la teoría de los elementos clásicos, identificando tamién como elementos al mercuriu y al azufre.[38]
Otros renombraos eruditos musulmanes de la dómina como Abū al-Rayhān al-Bīrūnī,[39] Avicena[40] y al-Kindi criticaron y refugaron les teoríes de la alquimia, particularmente la transmutación de los metales; y al-Tusi enunció una versión de la caltenimientu de la masa, al afirmar qu'un cuerpu material podía camudar pero nun sumir.[41] Al-Razi foi'l primeru en refugar a la teoría aristotélica de los cuatro elementos clásicos y marcó el camín de la química usando'l llaboratoriu nel sentíu modernu, amás de diseñar y describir más de venti instrumentos, dalgunos de los cualos siguen usándose anguaño como'l crisol o la retorta de destilación.
La alquimia del mundu islámicu influyó darréu n'Europa al ser traducíos al llatín los sos testos, sobremanera a partir del sieglu XII, xunto a los clásicos grecollatinos que sumieren d'Occidente. Por casu Paracelso (1493-1541), reformó la teoría de los cuatro elementos siguiendo les sos enseñances, y con solo una vaga conocencia de la química y la medicina oriental fundó un híbridu ente alquimia y ciencia al que denominó iatroquímica.

Problemes de la alquimia[editar | editar la fonte]
Dende'l puntu de vista modernu la alquimia presentaba dellos problemes. En primer llugar el so oxetivu nun yera l'ampliación de la conocencia d'una manera racionalista como anguaño entendemos una ciencia, sinón que'l so fin yera atopar materies mítiques como la piedra filosofal, y los descubrimientos esperimentales producir de forma colateral. Amás escarecía d'un sistema pa nomar los nuevos compuestos que s'afayaben, y el so llinguaxe yera esotéricu y vagu hasta'l puntu que los sos términos significaben coses distintes pa distintes persones. De fechu según The Fontana History of Chemistry (Brock, 1992):
El llinguaxe de la alquimia llueu desenvolvió un vocabulariu téunicu arcanu y reserváu diseñáu pa despintar información a los ensin empecipiar. En gran midida esti llinguaxe ye incomprensible pa nós güei, anque aparentemente los llectores del cuentu del criáu del canónigu de Geoffrey Chaucer y l'audiencia de El alquimista de Ben Jonson yeren capaces d'interpretar lo suficiente como pa rise d'ello.[42]
El cuentu «El criáu del canónigu» de los Cuentos de Canterbury (de finales del sieglu XIV) espón el llau más fraudulento de la alquimia, la pretensión de fabricar oru a partir de materies más barates. Tamién Dante Alighieri, un sieglu antes, amuesa'l so refugu a esti fraude al meter a tolos alquimistas nel infiernu del so Divina Comedia.
La alquimia tampoco disponía d'un métodu científicu lóxicu y consensuáu pa faer los esperimentos reproducibles. De fechu munchos alquimistas incluyíen ente les anotaciones de los sos métodos información irrelevante como los niveles de la marea o les fases de la Lluna. La naturaleza esotérica y el vocabulariu codificado de la alquimia al paecer sirvíen sobremanera pa despintar qu'en realidá nun teníen demasiaes certidumes. Yá nel sieglu XIV se evidenciaban los resquiebros na fachada de la alquimia, y muncha xente amosábase escéptica. P'haber avanzáu precisaría un métodu normalizáu que dexara a otros reproducir los esperimentos, y rexistralos d'una manera clara que dexara esponer lo que se sabía y lo que se desconocía.
En 1317, el papa Xuan XXII d'Avignon ordenó la espulsión de tolos alquimistas de Francia por falsificar moneda. En 1403 aprobóse una llei n'Inglaterra onde se penaba cola muerte la multiplicación de metales». Con too y con eso la alquimia nun sumió, yá que parte de les clases privilexaes y la realeza siguía creyendo que podía afayase la piedra filosofal y el mestranzu de la vida nel so provechu.[43] Mientres el Renacimientu la alquimia exotérica siguió siendo popular na forma de la iatroquímica de Paracelso, ente que l'alquimia espiritual tamién floriaba fiel a los sos raigaños platóniques, hermétiques y gnóstiques. Asina que la busca de la piedra filosofal nun foi abandonada a pesar de les escases meyores de la alquimia, y siguió siendo practicada por eruditos y médicos respetaos hasta principios del sieglu XVIII. Dellos prauticantes de la alquimia d'entamos de la era moderna anguaño son reconocíos polos sos grandes contribuciones a la ciencia como Jan Baptist van Helmont, Robert Boyle y Isaac Newton.
Sieglos XVII y XVIII: entamos de la química[editar | editar la fonte]


Los intentos práuticos d'ameyorar el refináu de les menas minerales y l'estraición de los metales a partir d'elles foi una importante fonte d'información pa los químicos del sieglu XVI. Ente ellos destaca Georgius Agricola (1494-1555), que publicó la gran obra De re metallica (Sobre los metales) en 1556. Na so obra describen los procesos de la dómina en minería, estraición de los metales y metalurxa, yá bien complexos y desenvueltos. Por casu la obra describe la diversidá de tipos d'altos fornos usaos pa la fundición de les menas minerales. Enceta la tema esaniciando'l misticismu que tenía acomuñáu enantes, creando una base práutica qu'otros pudieren desenvolver, y aguiyó l'interés polos minerales y la so composición. Nun ye casual que mente y use como referencia en numberoses ocasiones al autor de l'antigüedá Pliniu'l Vieyu y la so obra Naturalis Historia. Calificóse a Agricola como'l padre de la metalurxa.[44]
En 1605, Francis Bacon publicó The Proficience and Advancement of Learning (La capacidá y progresu del aprendizaxe), una obra científicu-filosófica que contién una descripción de cómo tendría de ser la práutica esperimental que darréu se conocería como'l métodu científicu.[45] En 1605 Michal Sedziwój publicó'l tratáu alquímico Novum Lumen Chymicum (La nueva lluz de la química), que propón per primer vegada la esistencia nel aire d'un alimentu pa la vida», que darréu se reconocerá como'l osíxenu (de primeres enrite desflogistizado). En 1615 Jean Beguin publicó Tyrocinium Chymicum (La práutica de la química), el primer llibru de testu de química, onde apaez la primer ecuación química.[46] En 1637 René Descartes publicó Discours de la méthode (El discursu del métodu), un ensayu que basa la investigación científica nos cálculos matemáticos y la rocea nos fechos ensin probar.
La obra del químicu holandés Jan Baptist van Helmont, Ortus medicinae (L'orixe de la medicina) publicada póstumamente en 1648, considérase la principal obra de transición ente la alquimia y la química, ya influyó notablemente en Robert Boyle. El llibru contién la resultancia de numberosos esperimentos y enuncia una versión inicial de la llei de caltenimientu de la masa. Baptist van Helmont, que trabayó nel periodu darréu posterior a Paracelso y el so iatroquímica, indicó qu'esistíen otres materies «insustanciales» amás del aire, y acuñó pa elles el nome de «gas» (del griegu caos). Amás de pola introducción de la pallabra gas nel vocabulariu científicu y ser el fundador de la química neumática, esperimentando con reaiciones ente gases, Jan Baptist van Helmont tamién ye recordáu anguaño poles sos idees sobre la xeneración bonal.
En 1669 el alquimista alemán Hennig Brandt afayó'l fósforu a partir de la orina.[47] Pa llogralo destiló un amiestu d'orina y arena (50 cubos). Al evaporar la urea llogró un material blanco que rellumaba na escuridá y amburaba con una llapada brillosa.

Robert Boyle[editar | editar la fonte]

Considérase que'l químicu inglés Robert Boyle (1627-1691) estremó definitivamente a la química de la alquimia al ameyorar el so métodu esperimental.[48] Anque la so investigación tien los sos raigaños claramente na tradición alquímica, anguaño reconozse a Boyle como'l primer químicu modernu, y por ello unu de los fundadores de la química moderna, y unu de los pioneros del métodu científicu esperimental modernu. Conózse-y principalmente pola llei de Boyle que presentó en 1662,[49] anque Boyle nun foi'l so descubridor orixinal. La llei describe la rellación inversamente proporcional qu'esiste ente la presión y el volume d'un gas, si caltién constante la temperatura nun sistema zarráu.[50][51]
Reconozse como un finxu científicu la publicación de la obra de Boyle The Sceptical Chymist: or Chymico-Physical Doubts & Paradoxes (El químicu escépticu: o les duldes y paradoxes quimio-físiques) en 1661, que se considera una pilastra fundamental del campu de la química. Na obra Boyle presenta la so hipótesis de que tolos fenómenos son la resultancia del choque de les partícules en movimientu. Boyle apela a los químicos por qu'esperimenten y afirma que los esperimentos contradicen que los elementos químicos llindar a los cuatro elementos clásicos. Tamién declaró que la química tendría de dexar de tar subordinada a la medicina o la alquimia, y tendría d'alzase al estatus de ciencia por sigo mesma. Destaca'l so defensa de la esperimentación científica rigorosa. Boyle creía que toles teoríes tendríen de probase esperimentalmente antes de ser consideraes ciertes. La so obra amás contién dalgunes de les primeres idees modernes sobre átomos, molécules y reaiciones químiques, polo que marcó l'entamu de la historia de la química moderna.
Boyle tamién trató de purificar les sustancies químiques pa llograr reaiciones reproducibles. Foi un defensor de la filosofía mecánica propuesta por René Descartes pa esplicar y cuantificar les propiedaes ya interaiciones de les sustancies químiques. Boyle yera un atomista, pero prefería la pallabra corpúsculu a átomu. Puntualizó que la división más pequeña de la materia a la que se calteníen les propiedaes yera a nivel de los corpúsculos. Amás realizó numberoses investigaciones con una bomba d'aire. Reparó que al sacar l'aire les llapaes escastábense y morríense los animales asitiaos dientro, y tamién faía baxar los niveles del barómetru. Boyle repitió los trés esperimentos de van Helmont, y foi'l primeru n'usar indicadores que camudaren de color cola acidez. Por tou ello Boyle ayudó a asitiar les pilastres de la revolución química cola so filosofía corpuscular mecánica.[52]
Teoría del floxistu[editar | editar la fonte]

A finales del sieglu XVII y principios de XVIII propunxo la teoría del floxistu pa intentar esplicar los procesos de combustión y aferruño-amenorgamientu por aciu la perda o tresferencia, respeutivamente, d'un supuestu fluyíu denomináu floxistu.[53] La teoría foi propuesta primeramente por Johann Becher y desenvuelta por Georg Stahl, dambos químicos alemanes. Becher postuló otra reforma de la teoría de los cuatro elementos na que solo la tierra y l'agua seríen componentes de les materies, en distintes proporciones, y el fueu y l'aire seríen puramente axentes de los tresformamientos. De la mesma esistiríen tres tipos distintos de tierres, caúna d'elles portadora d'una propiedá: l'aspeutu vítreu, la fluidez o volatilidá, y el calter inflamable. Pa esta postrera Georg Stahl acuño'l términu floxistu en 1702. Toa sustancia susceptible de sufrir combustión contendría cierta cantidá de floxistu, y el procesu de combustión consitiría básicamente na perda de dicha sustancia.
Conocer dende l'antigüedá que dellos sales metálicos podíen ser tresformaes de nuevu nos metales de partida. Stahl esplicó esti procesu suponiendo que los metales taben formaos por un cal y un principiu inflamable carente de masa, el floxistu, polo que la calcinación, esto ye, la formación del cal, podía esplicase, al igual que la combustión, como un desprendimientu de floxistu, que lliberábase del metal y dexaba el cal al descubiertu nes cenices. El procesu inversu, l'amenorgamientu del cal al metal, podía ser igualmente esplicada como una adición de floxistu. Si una sustancia rico en floxistu, como'l carbón, yera puesta en contautu con un cal metálico, podía tresferi-y el so floxistu y dar llugar a la formación del metal.
Joseph Priestley usó la teoría del floxistu nos sos esperimentos de química pneumática pa esplicar los tresformamientos de los gases. Priestley denominó a la residuu d'aire que quedaba tres un procesu de combustión «enrite flogistizado» (en realidá, un amiestu de nitróxenu y dióxidu de carbonu), pos pensaba que mientres la combustión dichu aire absorbiera tol floxistu que tenía capacidá d'allugar, y por eso cesaba la combustión. Siguiendo esta llinia de razonamientu, cuando Priestley caleció la cal colorao de mercuriu y recoyó un tipu d'aire que podía caltener más tiempu la combustión denominar «aire desflogistizado». Darréu Lavoisier llamar osíxenu.
La teoría del floxistu foi popular mientres el sieglu XVIII hasta que Antoine Lavoisier la refutó na so obra Réflexions sur le phlogistique, pour sirvir de suite à la théorie de la combustion et de la calcination (Reflexones sobre'l floxistu, pa formar parte de la teoría de la combustión y la calcinación) publicada en 1777. Según Stahl cualquier sólidu lliberaba floxistu so l'aición del fueu, depués tres la combustión perdería masa o lo caltendría (según el floxistu tuviera masa o non). Sicasí, Lavoisier fixo esperimentos xamuscando metales y dempués de la calcinación en dalgunos el pesu de la residuu (los óxidos) yera mayor que'l cuerpu inicial. Nestos casos el floxistu tendría un pesu negativu, lo que resultaba absurdu, y demostraba la inconsistencia de la teoría del floxistu.
Descubrimientos del sieglu XVIII[editar | editar la fonte]
Nel sieglu XVIII multiplicaron los descubrimientos de nuevos elementos, gracies al cambéu nos métodos d'investigación. Un fechu ensin precedentes dende l'antigüedá, yá que nos dos milenios anteriores habíense descubiertu solu cinco (arsénicu, antimoniu, cinc,[55] bismutu y fósforu). Alredor de 1735 el químicu suecu Georg Brandt analizó un pigmentu azul escuru atopáu na mena del cobre afayando lo que darréu conoceríamos como cobaltu. En 1748 l'español Antonio de Ulloa publicó la descripción d'un nuevu metal, el platín.[56] En 1751 un discípulu de Stahl, Axel Fredrik Cronstedt, identificó nuna impureza del mineral del cobre otru nuevu metal, el níquel. A Cronstedt considérase-y unu de los fundadores de la mineraloxía moderna.[57] En 1766 el químicu inglés Henry Cavendish aislló'l hidróxenu, al que llamó «aire inflamable». En 1773 el suecu Carl Wilhelm Scheele afayó'l osíxenu, al que llamó «aire de fueu»,[58] anque al nun publicar darréu'l so afayu avagó Joseph Priestley a publicar 1774, n'afayando'l mesmu gas independientemente al cual llamó «aire deflogistizado».[59] En 1783 los hermanos españoles Juan José y Fausto Elhuyar consiguieron aisllar el wolframiu a partir del mineral wolframita.[60][61]
Nel sieglu tamién s'afayaron destacaos compuestos. En 1754 l'escocés Joseph Black aislló'l dióxidu de carbonu, al que llamó «aire invariable».[62] En 1757 el francés Louis Claude Cadet de Gassicourt, mientres investigaba los compuestos del arsénicu creó'l líquidu fumante de Cadet, que darréu se sabría que contenía óxidu de cacodilo, y por ello ye consideráu'l primer compuestu organometálico que se llogró sintetizar.[63] Y amás en 1758 Joseph Black formuló'l conceutu de calor latente pa esplicar los cambéu d'estáu.[64]
Antoine Lavoisier[editar | editar la fonte]

Anque la investigación química puede remontase a l'antigua Babilonia, Exiptu, y especialmente a Persia y Arabia de la Edá d'Oru del islam, la química florió a partir de la dómina d'Antoine Lavoisier, un químicu francés reconocíu como'l padre de la química moderna». En 1789 Lavoisier estableció formalmente la llei de caltenimientu de la materia, que nel so honor tamién se conoz como «Llei Lomonósov-Lavoisier».[65] Pa demostrala realizó múltiples esperimentos. Demostró con midíes meticulosas que les transmutaciones nun yeren posibles, por casu, nun se tresformaba l'agua en tierra, sinón que'l sedimentu que se repara al ferver agua procedía del contenedor; o que al quemar al enrite fósforu y azufre, probó qu'anque los productos pesaben más, el pesu ganáu procedía del aire.

Repitiendo los esperimentos de Priestley demostró que l'aire taba compuestu de dos partes (nun yera un elementu), y una d'elles combinábase colos metales pa formar los cales. En Considérations Générales sur la Nature des Acides (1778) demostró que la parte del aire responsable de la combustión tamién yera la fonte de l'acidez en disoluciones. Al añu siguiente nomó a esta parte osíxenu (del griegu formador d'ácidos), y a la otra azote (ensin vida). Por ello considérase a Lavoisier el descubridor del osíxenu xunto a Preistley y Scheele. Tamién reparó que l'aire inflamable» afayáu por Cavendish al combinalo con osíxenu producía una condensación, como informó Priestley, que paecía ser agua (depués tampoco l'agua yera un elementu), por ello denominó a esti gas hidróxenu (del griegu formador d'agua»).
Como s'indicó nel apartáu anterior, en Reflexions sur le Phlogistique (1783) Lavoisier refutó la teoría del floxistu pa la combustión. En Rusia Mikhail Lomonosov independientemente llegó a conclusiones similares sobre'l caltenimientu de la materia y el floxistu. Amás Lomonosov antemanó la teoría cinética de los gases, al considerar que'l calor provenía d'una forma de movimientu.
Lavoisier trabayó con Claude Louis Berthollet y otros pa escurrir un sistema de nomenclatura química que foi la base del sistema modernu de nomar compuestos químicos. Nel so Methods of Chemical Nomenclature (1787), Lavoisier inventó la forma de nomar y clasificar compuestos que s'usa principalmente na actualidá, qu'inclúi nomes como ácidu sulfúrico, sulfatos y sulfitos. En 1785 Berthollet determinó la composición elemental del amoniacu. Esi mesmu añu Berthollet foi'l primeru n'usar el gas cloru como blanqueante comercial, y en 1789 foi'l primeru en fabricar llexía al burbuyar gas al traviés d'una solución de carbonatu de sodiu, consiguiendo una solución de hipoclorito sódicu. Tamién estudió y foi'l primeru en producir otru fuerte oxidante y blanqueante de cloru, el cloratu de potasiu (KClO3), conocíu como sal de Berthollet. Berthollet tamién ye conocíu poles sos contribuciones a la teoría del equilibriu químicu al traviés del mecanismu de reaición reversible.
La obra de Lavoisier Traité Élémentaire de Chimie (Tratáu elemental de química, 1789) foi'l primer llibru de testu de la química moderna, y presentaba un puntu de vista unificáu de les nueves teoríes químiques, contenía una declaración clara de la llei de caltenimientu de la masa, y negaba la esistencia del floxistu. Amás presentaba una llista d'elementos, o sustancies que nun podíen descomponese, qu'incluyía al osíxenu, el nitróxenu, l'hidróxenu, el fósforu, el mercuriu, el cinc y l'azufre. Sicasí, na so llista tamién s'incluyía la lluz y el calóricu, qu'él creía que yeren sustancies materiales. Na obra Lavoisier remarcó que la observación yera la base de la so química, afirmando que:
Intenté (...) llegar a la verdá axuntando fechos, pa suprimir no posible el razonamientu, que de cutiu ye'l responsable d'engañar, pa siguir no posible la lluz de la observación y del esperimentu.

Lavoisier demostró que los organismos vivos descomponíen y recomponíen l'aire atmosférico de la mesma forma que lo faía una llapada. Xunto a Pierre-Simon Laplace, Lavoisier usó un calorímetru pa envalorar el calor por unidá de dióxidu de carbonu producíu nuna combustión. Y afayó unes medies similares pa les llapaes y los animales, lo qu'indicaba que los animales producíen enerxía per mediu d'un tipu de combustión. Amás afayó que'l diamante yera una forma cristalina del carbón.
Sicasí como ye lóxicu, na so obra non tou fueron aciertos. Lavoisier nun creía nel atomismu y pensaba que la esistencia real de los átomos yera filosóficamente imposible. Lavoisier creía na teoría de los radicales y pensaba que los radicales funcionaben como un solu grupu que se combinaría col osíxenu nes reaiciones. Creía que tolos ácidos conteníen osíxenu. A pesar d'ello, el llabor de Lavoisier foi fundamental pa la ciencia química. Al impulsu que se produció na investigación basáu na so llei de caltenimientu de la masa, la so teoría sobre la combustión por aciu l'osíxenu, amás de la teoría corpuscular mecánica, conozse como revolución química. Tres la so obra la química adquirió una naturaleza puramente cuantitativa, lo que dexaría faer predicciones fiables. La so contribución a la revolución química foi la resultancia principalmente del so esfuerciu consciente d'encaxar tolos sos esperimentos nel marcu d'una sola teoría. Estableció de forma consistente l'usu del equilibriu químicu, usó'l descubrimientu del osíxenu pa refutar la teoría del flojisto y desenvolvió un nuevu sistema de nomenclatura química. Lamentablemente la so brillantez y autoridá científica nun evitaron que Lavoisier fuera degolláu mientres la Revolución francesa.

Volta y la so pila[editar | editar la fonte]
El físicu italianu Alessandro Volta foi unu de los pioneros nos estudios sobre la eletricidá. En 1775 Volta perfeccionó y popularizó l'electróforo, un dispositivu con dos discos metálicos separaos por un conductor húmedu, pero xuníos con un circuitu esterior, capaz de producir eletricidá estática. En 1794 Volta revisó los estudios sobre la eletricidá animal». En 1780 Luigi Galvani reparara que al poner en contauto dos metales distintos col músculu d'una xaronca aniciábase l'apaición de corriente llétrica. A Volta interesó-y la idea y empezó a esperimentar con metales namái, y llegó a la conclusión de que'l texíu muscular animal nun yera necesariu pa producir la corriente llétrica. Esti afayu amenó un fuerte discutiniu ente los partidarios de la eletricidá animal y los defensores de la eletricidá metálica, pero la demostración, realizada en 1800, del funcionamientu de la primera pila llétrica certificó la victoria del bandu favorable a les tesis de Volta.[66]
El so pila voltaica de 1800 consistía nun apilamientu de dellos pares de discos de cobre y cinc alternaos (electrodos) separaos por una capa de tela o cartón papada en salmoria (electrolitu) p'amontar la conductividá.[67] Cuando se conectaba la parte cimera y l'inferior con un cable separaos, y perdía poca carga col tiempu cuando nun la utiliza, colo que Volta consiguió la primera batería llétrica pa producir eletricidá. Por ello considérase a Volta el fundador de la electroquímica.[68] A partir d'entós van usase les piles voltaiques (o galvániques) nel estudiu les reaiciones redox y los sos productos. Amás Alessandro Volta ente 1776 y 1778 dedicar al estudiu de la química de los gases y foi'l descubridor del metanu.
Sieglu XIX: resurdimientu de la teoría atómica[editar | editar la fonte]
En tando aparcáu'l atomismu dende l'antigüedá y namái esbozáu nos modelos mecánicos corpusculares, la teoría atómica ye retomada por John Dalton, quien postuló que los átomos yeren partícules indivisibles que permanecen inalteraes nos compuestos, a partir de lo cual pudieron establecese les lleis estequiométricas, base de l'actual estequiometría.
A lo llargo del sieglu XIX la química tuvo estremada ente los siguidores y detractores de la teoría atómica de Dalton, como Wilhelm Ostwald y Ernst Mach. Los impulsores más decidíos de la teoría atómica inicial fueron Amedeo Avogadro, Ludwig Boltzmann, ente otros, que consiguieron grandes meyores na comprensión del comportamientu de los gases. La disputa sobre la esistencia de los átomos atayaríase definitivamente cola esplicación del efeutu browniano por Albert Einstein en 1905 y los respeutivos esperimentos de Jean Perrin. Munchos fueron los investigadores que trabayaron so la hipótesis atómica. Svante Arrhenius albidró en parte la estructura interna de los átomos proponiendo la so teoría de la ionización nes disoluciones. Anque la so verdadera estructura nun s'acolumbraría hasta principios del sieglu XX, a partir de los trabayos d'Ernest Rutherford, siguíos pol modelu atómicu de Bohr.
John Dalton[editar | editar la fonte]

En 1803 el científicu inglés John Dalton propunxo la llei de Dalton, que rellaciona les presiones parciales de los componentes d'un amiestu de gases cola presión total del amiestu.[69] El conceutu foi afayáu en 1801, y tamién se conoz como llei de les presiones parciales.

Pero la principal contribución de Dalton a la química foi una nueva teoría atómica en 1803, onde afirmaba que tola materia ta formada por pequeñu partícules indivisibles denominaes átomos. En 1808 Dalton publicó per primer vegada A New System of Chemical Philosophy (Un nuevu sistema de filosofía química, 1808-1827), na que desenvolvía la primer descripción moderna d'una teoría atómica. Nesta obra identificaba los elementos químicos como un tipu de partícules, y refuga la teoría d'afinidaes químiques defendida por Étienne François Geoffroy y Isaac Newton, ente otros. Dalton esplicó la so teoría formulando una serie d'enunciaos simples:[70]
- La materia ta formada por partícules bien pequeñes llamaes átomos, que son indivisibles y non pueden destruyise.
- Los átomos d'un mesmu elementu son iguales ente sigo, tienen la mesma masa y propiedaes. Los átomos de distintos elementos tienen mases distintes.
- Los átomos permanecen ensin división, entá cuando se combinen nes reaiciones químiques.
- Los compuestos químicos formar al xunise átomos de dos o más elementos distintos.
- Los átomos, al combinase pa formar compuestos guarden rellaciones simples.
- Los átomos d'elementos distintos pueden combinase en proporciones distintes y formar más d'un compuestu.
A pesar de la so utilidá y gran aceptación mientres tol sieglu XIX, la teoría atómica de Dalton tenía imprecisiones (los dos primeros enunciaos nun son del tou ciertos) y presentaba munches llagunes: nun esclariaba nada sobre la estructura del átomu, nin esplicaba les propiedaes de los elementos, nin cuálos yeren les causes de que se xunieren pa formar compuestos.
Amás de definir átomos, elementos y compuestos, Dalton infirió les proporciones de dellos elementos nos sos compuestos, partiendo de los pesos de los sos reactivos, per mediu del pesu atómicu relativu usando al hidróxenu como unidá de masa na comparanza colos demás elementos. Siguiendo les tesis de Jeremias Benjamin Richter (conocíu por acuñar el términu estequiometría), propunxo que cuando los elementos químicos combinar pa dar más d'un compuestu xunir en distintes proporciones fixes y enteres. Esto conozse como la Llei de les proporciones múltiples y foi incluyida na so obra New System of Chemical Philosophy. La llei de les proporciones múltiples ye una de les lleis básiques de la estequiometría y unu de les pilastres de la so teoría atómica. Curiosamente a pesar de la importancia d'incluyir la idea d'átomos como entidaes físiques reales en A New System of Chemical Philosophy, y la creación d'un sistema de símbolos químicos pa ellos, esta obra dedica casi tol so testu a la teoría calórica en llugar d'a l'atomismu.
Per otru llau foi'l químicu francés Joseph Proust quien propunxo la Llei de proporciones definíes, qu'afirma que los elementos siempres se combinen pa formar un determináu compuestu facer en proporciones de númberos enteros y senciellos, basándose en dellos esperimentos realizaos ente 1797 y 1804.[71] La llei de proporciones múltiples y la de proporciones definíes son la base de la estequiometría. Estos dos lleis por sigo mesmes nun prueben la esistencia de los átomos, pero son difíciles d'esplicar ensin asumir que los compuestos formar pola combinación d'átomos en proporciones constantes.
Jöns Jacob Berzelius[editar | editar la fonte]

Un químicu suecu discípulu de Dalton, Jöns Jacob Berzelius, embarcar nun programa sistemáticu de midíes cuantitatives precises de les sustancies químiques, asegurándose de la so pureza. A partir de les cualos en 1828 arrexuntó una tabla de pesos atómicos relativos, onde al osíxenu asignábase-y el 100, y qu'incluyía tolos elementos conocíos na dómina. Esti trabayu apurrió pruebes a favor de la teoría atómica de Dalton: que los compuestos químicos inorgánicos taben formaos por átomos combinaos en proporciones de númberos enteros. Determinó la composición elemental exacta de gran númberu de sustancies. Les sos resultaos confirmaron la llei de proporciones definíes de Proust. Nos sos pesos usó como patrón al osíxenu, asignándo-y el valor exactu de 100, y a partir d'él midió'l pesu de 43 elementos. Al afayar que los pesos atómicos nun yeren múltiplos exactos del pesu del hidróxenu Berzelius refugó la hipótesis de Prout, que supónía que los elementos taben formaos por átomos d'hidróxenu.
Pa simplificar los esperimentos na so estensa determinación de pesos atómicos introdució'l sistema de símbolos químicos y notación, que publicó na so obra de 1808 Lärbok i Kemien (Manual de química), na que los nomes de los elementos fueron embrivíos con una o dos lletres de les iniciales de los sos nomes en llatín. Esti sistema de notación, nel que los elementos espresar por aciu símbolos simples y les sos proporciones indicar con númberos, básicamente ye'l mesmu que s'usa anguaño. La única diferencia ye qu'en llugar de poner los númberos nel subíndice como anguaño (ej: H2O), Berzelius usaba superíndices (H²O).
Acreitar a Berzelius el descubrimientu de los elementos siliciu, seleniu, toriu y ceriu. Amás los discípulos que trabayaben nel llaboratoriu de Berzelius identificaron el litiu y redescubrieron el vanadiu (descubiertu orixinalmente por Andrés Manuel del Río en 1801 y depués refugáu al creelo cromu). Berzelius desenvolvió la teoría de los radicales pa la combinación química, que caltenía que les reaiciones producir por aciu grupos estables d'átomos denominaos radicales que s'intercambien ente les molécules. Creía que los sales son compuestos d'un ácidu y una base, y afayó que los aniones de los ácidos yeren atraíos polos electrodos positivos (el ánodu), ente que los cationes d'una base yeren atraíos pol electrodu negativu (el cátodu). Berzelius nun creía na teoría del vitalismo, nel so llugar pensaba qu'había una fuercia regulador que producía la organización de los texíos de los organismos. Amás atribúyese a Berzelius la creación de los términos químicos "catálisis", "polímeru", "isómero" y "alótropo", anque les sos definiciones orixinales difieren considerablemente de les actuales. Por casu el términu "polímeru" qu'acuñó en 1833 describía compuestos orgánicos que compartíen la mesma fórmula empírica pero teníen distintu pesu molecular, el mayor yera polímeru del más pequeñu, como la glucosa (C6H12O6, de la que se desconocía la so estructura) y el formaldehídu (CH2O). Por tou ello Berzelius ye reconocíu como unu de los padres de la química moderna, xunto a Lavoisier, Boyle y Dalton.
Davy y l'electrólisis[editar | editar la fonte]

El químicu inglés Humphry Davy foi un pioneru nel campu de la electrólisis (que consiste n'usar la eletricidá nuna célula electrolítica onde se producen reaiciones d'aferruño-amenorgamientu pa dixebrar los compuestos ellí conteníos) p'aisllar dellos elementos nuevos. Davy descompunxo por electrolisis dellos sales fundíos y consiguió afayar el sodiu y el potasiu. El potasiu foi'l primer metal aislláu por aciu electrólisis, a partir la potasa cáustica (KOH). Antes del sieglu XIX desconocíen les diferencies ente los sales de sodiu y potasiu. El sodiu foi aislláu'l mesmu añu a partir de la sosa cáustica fundida (NaOH). Cuando Davy enteróse que Berzelius y Pontin preparaben una axuntadura (axuntadura de calciu) por aciu la electrólisis de la cal en mercuriu, intentar él. Davy consiguió afayar el calciu en 1808 cola electrólis de la cal en óxidu de mercuriu.[72][73] Siguió trabayando cola electrólisis mientres tola so vida, en 1808, aislló'l magnesiu, l'estronciu y el bariu.[74][75]
Davy tamién esperimentó esneldando gases. Esti procedimientu esperimental casi resulta fatal en delles ocasiones, pero condució a afayar los inusuales efeutos del óxidu nitroso, que llevaríen a conocelo como gas de la risa. En 1774 el químicu suecu Carl Wilhelm Scheele afayó'l cloru y denominar «acedu desflogistizado marín» pensando equivocadamente que contenía osíxenu. Scheele reparó delles propiedaes del gas de cloru, como'l so efeutu blanqueante sobre'l tornasol, y el so efeutu mortal sobre los inseutos, el so color verde amarellentáu y el so golor similar al de l'agua regia. Sicasí, Scheele nun pudo publicar los sos afayos a tiempu. En 1810 Humphry Davy dio-y al cloru'l so nome actual (deriváu de la pallabra griega χλωρός (khloros) «verde amarellentáu») aportunando en que se trataba d'un elementu.[76] Amás demostró que nun se podía llograr osíxenu a partir de la sustancia conocida como acedu oximuriático (una solución de HCl). Esti descubrimientu rebatió la definición d'ácidu de Lavoisier que los consideraba compuestos d'osíxenu.
El yodu foi afayáu pol químicu francés Bernard Courtois en 1811.[77][78] Courtois dio muestres a los sos amigos, Charles Bernard Desormes (1777-1862) y Nicolas Clément (1779-1841), por que siguieren la investigación. Tamién-y dio daqué de sustancia a Joseph Louis Gay-Lussac y al físicu André-Marie Ampère. El 6 d'avientu de 1813, Gay-Lussac anunció que se trataba o bien d'un nuevu elementu, o bien d'un compuestu d'osíxenu.[79][80][81] Amás foi Gay-Lussac quien suxurió'l nome del yodu, a partir de la pallabra griega ιώδες (iodes) pal violeta (pol color del vapor de yodu).[77][79] De la mesma Ampère dio parte de la so amuesa a Humphry Davy. Davy fixo dellos esperimentos cola sustancia y diose cuenta de les sos semeyances col cloru.[82] Davy mandó una carta'l 10 d'avientu a la Royal Society of London onde afirmaba qu'identificara un nuevu elementu.[83] Lo que desamarró los discutinios ente Davy y Gay-Lussac sobre quién identificara primero al yodu como elementu, anque dambos reconocíen a Courtois como'l primeru n'aisllalo.
Gay-Lussac y les lleis de los gases[editar | editar la fonte]

El químicu francés Joseph Louis Gay-Lussac compartía con Lavoisier l'interés pol estudiu cuantitativu de les propiedaes de los gases. Dende'l so primer periodu d'investigación 1801-1802, manifestó que tolos gases espandíense proporcionalmente al aumentar la temperatura. A esta conclusión xeneralmente denominar llei de Charles, yá que Gay-Lussac concedió-y el creitu del descubrimientu a Jacques Charles, por llegar casi a les sos mesmes conclusiones na década de 1780 anque nun les publicara.[84] Esta llei tamién foi descubierta independientemente por John Dalton alredor de 1801, anque la descripción de Dalton ye menos meticulosa que la de Gay-Lussac.[85] En 1804 Gay-Lussac fixo dellos ventureros ascensos en globu aerostáticu d'hidróxenu hasta altores percima 7000 metros sobre'l nivel del mar que-y dexaron investigar otros aspeutos de los gases, una proeza que naide más realizó nos 50 años siguientes. Tomó midíes de la presión, la temperatura, el mugor y muestres d'aire, que más tarde analizó químicamente, amás de realizar midíes magnétiques a delles altitúes.
En 1808 Gay-Lussac anunció lo que probablemente foi'l so mayor llogru: a partir d'esperimentos propios y d'otros dedució que los gases a volume fixo caltienen constante la rellación ente la so presión y la temperatura. Y que los volumes de los posibles productos d'una reaición ente gases amás tán en proporción senciella colos volumes de los reactivos. N'otres pallabres que los gases so les mesmes condiciones de presión y temperatura reaccionen con otros en proporciones de volume de númberos enteros y pequeños. Estes conclusiones afigurar na llei de Gay-Lussac y la Llei de los volumes de combinación.
Gay-Lussac tamién participó xunto al so colega profesor na École Polytechnique, Louis Jacques Thénard, nes primeres investigaciones electroquímiques, y analizó los elementos descubiertos por esti mediu. Ente los sos llogros nesti campu destaca'l descubrimientu del boro, pola descomposición del acedu bórico usando potasiu fundíu. Dambos investigadores formaron parte de los alderiques de la dómina pa modificar la definición de los ácidos ya impulsar l'analís de los compuestos orgánicos p'afayar el so conteníu n'osíxenu ya hidróxenu.
Amedeo Avogadro[editar | editar la fonte]

Tres la publicación de la teoría atómica de Dalton en 1808, dalgunes de les sos idees centrales fueron rápido adoptaes pola mayoría de los químicos. Sicasí mientres mediu sieglu permaneció la incertidume de cómo se configuraría la teoría atómica y aplicaríase a les situaciones concretes. Por casu colos datos empíricos disponibles hasta'l momentu varios químicos de distintos países desenvolvieron diversos sistemes de pesos atómicos incompatibles. El físicu italianu Amedeo Avogadro (1776-1856) publicó en 1811 una obra qu'amosaba una salida a esta difícil situación. Presentó la hipótesis de que los volumes iguales de cualquier gas, a la mesma temperatura y presión, conteníen el mesmu númberu de molécules; polo cual la rellación ente los pesos moleculares de dos gases yera la mesma proporción que la qu'había ente les sos densidaes, nes mesmes condiciones de presión y temperatura. Amás Avogadro razonó que los gases corrientes nun taben formaos por átomos solitarios sinón por molécules que conteníen dos o más átomos (que yera l'orixe de los distintos pesos atómicos rexistraos). Asina Avogadro foi capaz de resolver el problema col que s'habíen topáu Dalton y otros cuando Gay-Lussac reportó que percima del los 100 °C el volume del vapor d'agua yera dos veces el volume del osíxenu usáu pa formala. Según Avogadro la molécula d'osíxenu estremar en dos átomos pa formar l'agua.
La hipótesis de Avogadro foi inorada mientres mediu sieglu en siendo publicada per primer vegada. Citáronse munches razones pa esti desinterés, incluyíos dellos problemes teóricos como'l dualismu propuestu por Jöns Jacob Berzelius que consideraba que los compuestos calteníense xuntos pola atraición de les cargues positivu y negativu, lo que fadría incompatible la esistencia de molécules formaes por dos átomos llétricamente similares, como'l casu del osíxenu. Amás esistía la barrera de que munchos químicos yeren ronciegos a adoptar métodos físicos (como les determinaciones de densidá del vapor) pa resolver los sos problemes. Sicasí, a mediaos de sieglu les figures más prominentes empezaron a considerar intolerable la diversidá caótica de sistemes de pesos atómicos y fórmules de compuestos en competencia, qu'abondaron por causa de la incertidume. Amás empezaron a atropase pruebes puramente químiques qu'indicaben que lo afirmao por Avogadro podría ser ciertu dempués de too. A mediaos de sieglu, químicos más nuevos como Alexander Williamson n'Inglaterra, Charles Gerhardt y Charles-Adolphe Wurtz en Francia y August Kekulé n'Alemaña, empezaron a proponer la reforma de la química teórica por que se afixera a la teoría de Avogadro.
Entamos de la síntesis orgánica y la so industria[editar | editar la fonte]
Dempués de que s'entendieren los principios de la combustión, apoderar de la química otru alderique de gran importancia: el vitalismo, la distinción esencial ente la materia orgánico y l'inorgánica. Esta teoría asumía que la materia orgánico solo podría ser producida polos seres vivos, atribuyendo esti fechu a una vis vitalis (fuercia vital) inherente a la mesma vida. En 1827 William Prout clasificó les biomoléculas en tres grupos: carbohidratos, proteínes y lípidos. Pero l'alderique del vitalismo atayóse cuando Friedrich Wöhler afayó por fuercia en 1828 cómo podía sintetizase la urea a partir de cianato de amonio, demostrando que la materia orgánico podía crease de manera química a partir de reactivos inorgánicos. A pesar d'ello caltiénse vixente la clasificación en química orgánica y inorgánica, ocupándose la primera esencialmente de los compuestos del carbonu y la segunda de los compuestos de los demás elementos.

Clave de colores:
carbonu • osíxenu
nitróxenu • hidróxenuEnantes Friedrich Wöhler y Justus von Liebig realizaron en 1825 el primer descubrimientu confirmáu y esplicáu d'isómeros, anque'l términu fuera acuñáu antes por Berzelius. Trabayando con acedu ciánico y acedu fulmínico, deducieron correutamente que la isomería yera la consecuencia del distintu allugamientu de los mesmos átomos na estructura molecular. Amás en 1832 Friedrich Wöhler y Justus von Liebig afayaron y esplicaron los grupos funcionales y los radicales na química orgánica, amás de sintetizar per primer vegada'l benzaldehídu.
Pela so parte Justus von Liebig realizó investigaciones que contribuyeron de forma crucial na agricultura y la bioquímica y trabayó na organización de la química orgánica. Liebig ye consideráu'l padre de la industria de los fertilizantes pol so descubrimientu de que'l nitróxenu ye un nutriente esencial pa les plantes, y la formulación de la llei del mínimu qu'indica la influencia individual de cada nutriente nes colleches.

Los postreros defensores del vitalismo negaben la cualidá de sustancia orgánico a un productu de refugaya como la urea. Pero en 1847 Hermann Kolbe consiguió sintetizar otra sustancia orgánico, el acedu acético, a partir de fontes totalmente inorgániques, quedando refutado ensin batura a duldes el vitalismo. La síntesis de la urea abrió'l camín pa les síntesis orgánica de cientos de productos. Yá en 1838 Alexandre Wosrerenski llogró la quinona a partir de la quinina. El desenvolvimientu de la química orgánica na segunda metá del sieglu XIX tuvo impulsáu primeramente pola busca de nuevos colorantes o tintes sintéticos. Hasta la dómina solo podía tiñise por aciu productos naturales como la cochinilla que resultaben bien caros. El descubrimientu de l'anilina por Runge y la primer síntesis d'un colorante artificial realizada por Perkin abrió grandes posibilidaes comerciales. En 1856, William Henry Perkin, con 18 años, desafiáu pol so profesor August Wilhelm von Hofmann intentaba sintetizar, usando como precursor alquitrán de hulla, la quinina, la melecina contra la malaria, qu'hasta entós yera escasa por ser un productu natural. N'unu de los intentos Perkin aferruñó anilina usando dicromato potásicu, les impureces de toluidina reaccionaron cola anilina produciendo un precipitáu negru, lo que paecía indicar una síntesis fallida. Al llimpiar el matraz con alcohol, Perkin notó que la solución volvíase morada, por causa de un subproductu que resultaría ser el primer colorante sintéticu, la malveína o malva de Perkin. Esti descubrimientu aniciaría la industria de los tintes sintéticos, una de les primeres industries químiques d'ésitu. En 1865 Adolf von Baeyer empezó a fabricar l'añil, el tinte de los pantalones vaqueros, hasta entós llográu del índigo, un finxu na industria de la química orgánica que revolucionó la industria de los tintes.
Otra importante industria de compuestos orgánicos na dómina foi la de los esplosivos. En 1847, el químicu italianu Ascanio Sobrero afayó la nitroglicerina, que revolucionaría la minería, pero que resultaba desaxeradamente peligrosa. El químicu suecu Alfred Nobel afayó que cuando la nitroglicerina yera absorbida por una sustancia inerte como la tierra de diatomees, resultaba más segura y afechisca; y patentó esti amiestu en 1867 col nome de dinamita. Nobel darréu combinó la nitroglicerina con dellos compuestos de nitrocelulosa, similares al colodión, qu'en combinación d'otru esplosivu de nitratu resultó una receta más eficiente. El compuestu llográu, una sustancia xelatinoso tresparente con un poder esplosivo mayor que la dinamita, denominóse gelignita y foi patentada en 1876. Esti descubrimientu foi siguíu por un ensame de combinaciones similares, que se modificar pola adición de nitratu potásicu y otres sustancies.
En 1855, Benjamin Silliman Jr. empecipió los métodos de craqueo del petroleu, que son la base de la industria petroquímica actual.[86] La importancia de los derivaos del petroleu fixeron que la industria derivada de la química orgánica adquiriera la dimensión que tien anguaño, con productos como los plásticos, los carburantes, los adesivos, etc. La industria de los plásticos empecipiar en 1862 cuando Alexander Parkes amosó na esposición universal de Londres la parkesina, unu de los primeros polímeros sintéticos. Anque'l primer plásticu comercializáu a gran escala (la baquelita) nun empezar a la so distribución hasta l'entamu del sieglu XX.
La fabricación industrial de fármacos sintéticos empecipiar cola aspirina en 1897, cuando Felix Hoffmann afayó nos llaboratorios Bayer un procesu pa llograr acedu acetil salicílico a gran escala y con gran pureza.
Congresu de Karlsruhe y los sos antecedentes[editar | editar la fonte]

En 1840 Germain Hess propunxo la llei de Hess, unu de los primeros pasos escontra la llei de caltenimientu de la enerxía, qu'establez que la enerxía absorbida o desprendida nuna reaición depende solo de los reactivos iniciales y productos finales, ye independiente del tipu o númberu de pasos entemedios. En 1848 William Thomson (barón de Kelvin) estableció'l conceutu de cero absolutu, la temperatura a la que toles molécules detienen el so movimientu por completu. En 1849 Louis Pasteur afayó que l'amiestu racémica d'acedu tartárico tratar d'un amiestu de isómeros levógiros y dextrógiros, clarificando la naturaleza de la rotación óptica empecipiando'l campu de la estereoquímica.[87]
En 1852, August Beer estableció la llei de Beer, que rellaciona la intensidá de lluz absorbida pola disolución d'una sustancia cola so concentración y les propiedaes de dicha sustancia. Básase parcialmente nuna obra anterior de Pierre Bouguer y Johann Heinrich Lambert. Esta fórmula va ser la base de la téunica analítica conocida como espectrofotometría,[88] l'analís de sustancies químiques por aciu la comparanza del tipu y cantidá de lluz qu'absuerben.

La hipótesis de Avogadro empezó a consiguir aceptación ente los químicos solo dempués de que'l so compatriota Stanislao Cannizzaro demostrara'l so valor en 1858, dos años dempués de la muerte de Avogadro. La investigación de Cannizzaro orixinalmente centrar nel analís de productos naturales y les reaiciones de los compuestos arumosos. En 1853, afayó que cuando se trataba'l benzaldehídu con una base llográbase una amiestu d'acedu benzóico y alcohol bencílicu, un fenómenu conocíu anguaño como reaición de Cannizzaro. Cannizzaro esplicó nun folletu escritu en 1858 que cola aplicación de les idees de Avogadro podía construyise una teoría estructural química robusta y consistente, y que coincidía con casi toles pruebes empíriques disponibles na dómina. Por casu, señaló que dellos gases elementales yeren monoatómicos, anque la mayoría yeren diatómicos, y unos pocos yeren inclusive más complexos. Otru puntu de discutiniu que trataba foi les fórmules de los compuestos de metales alcalinos (como'l sodiu) y los alcalinotérreos (como'l calciu). En vista de les sos llamatives semeyances químiques la mayoría de los químicos asignáren-yos el mesmu tipu de fórmula. Cannizzaro discrepaba y asitió a estos metales en dos grupos distintos lo qu'esaniciaba ciertes anomalíes que se daben al intentar deducir les sos propiedaes a partir de los sos pesos atómicos. Lamentablemente el folletu de Cannizzaro primeramente solo publicóse n'Italia y tuvo bien poco espardimientu.
El verdaderu impautu del pasquín de Cannizzaro tuvo llugar nel congresu de Karlsruhe, el primer congresu internacional de química que s'axuntó na ciudá alemana de Karlsruhe en setiembre de 1860, col oxetivu principal d'unificar criterios. Taba entamáu por August Kekulé, Charles Adolphe Wurtz y Karl Weltzien,[89] y rexuntó a los químicos europeos más importantes de la dómina. Cannizzaro foi bien elocuente, lóxicu y didácticu na so esposición, causando una gran impresión na asamblea. Amás el so amigu Angelo Pavesi distribuyó'l so folletu ente tolos asistentes a la fin de la xunta, que la so llectura convenció definitivamente a la mayoría.[90] Asina Cannizzaro desempeñó un papel fundamental na reforma qu'impunxo la tesis de Avogadro. El sistema de formulación y pesos atómicos resultante foi adoptáu pola mayoría de los químicos, y ye n'esencia'l que s'usa anguaño.
Espectroscopía y tubos de descarga[editar | editar la fonte]

A mediaos del sieglu XIX creáronse dos téuniques que resultaríen fundamentales pal estudiu de la estructura del átomu: la espectroscopía y los tubo de descarga. Ente 1859 y 1860 Robert Bunsen y Gustav Kirchhoff crearon l'analís d'espectros. Los espectros atómicos son series de llinies que rexistren la enerxía emitida o absorbida polos átomos. Nun espectrómetru escitábase una muestra gaseosa, xeneralmente calecer, y faíase pasar la lluz resultante por un prisma que dixebraba la enerxía de distintes frecuencies, que s'imprimíen faciéndoles pasar por una placa fotográfica. Si l'espectru yera d'absorción lo que se descomponía yera la lluz que se faía pasar al traviés de la muestra de gas, y rexistrábense les frecuencies qu'absorbía. La resultancia yera una tira de papel con series de llinies en distintes posiciones según los distintos elementos, que representaben les frecuencies d'emisión o absorción carauterístiques de cada elementu. Bunsen y Kirchoff usaron la espectroscopía pal analís químicu, al poder identificar con esta téunica la presencia de sustancies nueves nes muestres, y asina consiguieron afayar el cesio y el rubidiu. Aína los científicos diéronse cunta que les llinies de los espectros disponer de forma periódica en series matemáticamente formulables, y darréu acomuñaríense cola estructura de los átomos.

Los tubos de descarga consistíen en tubos de vidriu nos que se faía parcialmente'l vacíu, polo que nel so interior quedaba un gas en concentración bien pequeña (denomináu gas enrarecido). Dientro agospiábense amás dos bornes separaos (ánodu y cátodu) d'un circuitu llétricu, y estudiábase lo qu'asocedía nel interior cuando se faía pasar una corriente llétrica al traviés del tubu. El químicu y físicu inglés William Crookes foi'l pioneru nel campu de los tubos de descarga, al inventar el tubu de Crookes, un tubu de descarga esperimental nel que pudo estudiar el comportamientu de los rayos catódicos que lo travesaben. Crookes destacó por estos estudios de los rayos catódicos al resultar fundamentales pal desenvolvimientu de la física atómica, yá que ayudaron a desvelar la estructura del átomu. Les sos investigaciones consistieron en reparar los efeutos de les descargues llétriques nel espaciu escuru alredor del cátodu, asitiáu nel interior de los tubos que teníen una atmósfera bien tenue de gas, anguaño ye denomináu espaciu escuru de Crookes nel so honor. Demostró que los rayos catódicos mover en llinies rectes y producíen fosforescencia al topetar con determinaes sustancies (depués taben formaos por partícules materiales cargaes negativamente). Amás Crookes aplicó les téuniques espectroscópicas pa estudiar los compuestos de seleniu. En 1861 Crookes usó'l mesmu procesu p'afayar el taliu en dellos depósitos seleníferos. Siguió trabayando col nuevu elementu, aisllar y estudió les sos propiedaes, y en 1873 determinó'l so pesu atómicu.
Kekulé y l'estructura orgánica[editar | editar la fonte]


La contribución más importante del químicu alemán Friedrich August Kekulé von Stradonitz foi la so teoría estructural pa los compuestos orgánicos, resumida en dos artículos publicaos en 1857 y 1858 y desenvuelta en gran detalle na so popular obra Lehrbuch der organischen Chemie (Manual de química orgánica), que'l so primer tomu apaeció en 1859 y terminó teniendo cuatro volúmenes. Kekulé esplicó que los átomos de carbonu tetravalentes (que pueden formar cuatro enllaces químicos) xúnense unos a otros pa formar cadenes, que denominó cadena de carbonos o carboesqueleto, y col restu de valencies pueden xunise a otros tipos d'átomos (como hidróxenu, osíxenu, nitróxenu y cloru). Taba convencíu de que yera posible atopar esta estructura en toles molécules orgániques, siquier en toles conocíes na dómina. Kekule nun yera l'únicu químicu de la dómina en creelo. El químicu escocés Archibald Scott Couper publicó una teoría similar casi coles mesmes, y el rusu Aleksandr Butlerov fixo enforma por clarificar y espandir la teoría. Sicasí Kekulé foi'l principal difusor de la teoría y les sos idees prevalecieron na comunidá científica.
En 1864, Cato Maximilian Guldberg y Peter Waage, a partir de les idees de Claude Louis Berthollet propunxeron la ley d'aición de mases. En 1865, Johann Josef Loschmidt determinó'l númberu exactu de molécules que contién un mol de sustancia, darréu denomináu constante de Avogadro.
En 1865, August Kekulé basóse parcialmente nel trabayu de Loschmidt, ente otros, pa establecer la estructura del bencenu, esplicándola como un aniellu de seis átomos de carbonu con enllaces simples y dobles alternaos. La novedosa propuesta de Kekulé d'estructura cíclica del bencenu foi bien polémica pero naide na dómina apurrió una meyor. Anguaño sábese que gran parte de los compuestos orgánicos contienen estructures cícliques como'l bencenu, denominaes arumoses.
Mendeléyev y la tabla periódica[editar | editar la fonte]
En 1869, los científicos yá habíen descubiertu 66 elementos distintos y determinaren la so masa atómico. Comprobaron que dellos elementos teníen propiedaes químiques similares y hubo dellos intentos de clasificalos según delles d'elles con más o menos aciertu. En 1829 el químicu J. W. Döbereiner entamó un sistema de clasificación d'elementos nel qu'estos se rexuntaben en grupos de trés denominaos tríadas. Les propiedaes químiques de los elementos d'una tríada yeren similares y les sos propiedaes físiques variaben de manera ordenada cola so masa atómico. En 1862 Alexandre-Emile Béguyer de Chancourtois publicó'l so héliz telúrica, una clasificación tridimensional de los elementos. En 1864 John Newlands propunxo la llei de les octaves y el mesmu añu Lothar Meyer desenvolvió otra clasificación con 28 elementos entamaos según el so valencia.


Pero quien terminó dando sentíu a una llista ordenada de los elementos conocíos (que nos ayudar a entender la estructura interna de los átomos) foi Dmitri Ivanovich Mendeléyev al desenvolver la primera tabla periódica de los elementos moderna. El químicu rusu Mendeléyev albidró qu'había dalgún tipu d'orde ente los elementos y pasó más de trenta años recoyendo datos y dando forma al conceutu, primeramente col enfotu de esclariar el desorde pa los sos alumnos. Mendeléyev afixo los 66 elementos conocíos nesi momentu na so tabla periódica por orde creciente de pesu atómicu, pero tamién atendiendo a les sos propiedaes, y atinó al dexar buecos na tabla pa elementos inda non descubiertos. Mendeléyev afayó que cuando s'ordenar los elementos químicos en ringlera según aumentaba'l pesu atómicu, hasta llegar a unu que tuviera propiedaes similares al inicial, que s'asitiaría nuna nueva fila debaxo, na tabla resultante atopábense patrones recurrentes, o periodicidad, nes propiedaes de los elementos tantu nes files (periodos) como nes columnes (grupos). Publicó'l so descubrimientu en 1869 na so obra Principios de química. Amás el so sistema dexó-y predicir con bastante exactitú les propiedaes d'elementos ensin afayar hasta'l momentu. Na so versión de la tabla de 1871, predixo les propiedaes que tendríen probablemente tres elementos inda non afayaos a los que denominó ekaboro (Eb), ekaaluminio (Ea) y ekasilicio (Es), que coincidieron coles del escandiu, galio y xermaniu, al ser descubiertos, lo que consiguió l'aceptación xeneralizada d'esti sistema d'ordenación.
Sicasí, la tabla de Mendeléyev nun yera del tou perfecta. Darréu tres el descubrimientu de dellos elementos nuevos y de perfeccionase los métodos de determinación de les mases atómiques, afayóse que dellos elementos nun taben nel orde correutu. La causa d'esti problema determinar más palantre el químicu inglés Henry Moseley, cuando se conociera meyor la naturaleza del átomu, quién afayó que lo que determinaba un claru patrón periódicu de les propiedaes de los átomos, ye'l númberu de protones que contién cada elementu nel so nucleu, o númberu atómicu, y non la masa atómico. Amás nun apaecía nenguna columna pa los gases nobles, pero neses feches nun se conocía inda nengunu.
Josiah Willard Gibbs[editar | editar la fonte]

La obra del físicu d'Estaos Xuníos J. Willard Gibbs sobre les aplicaciones de la termodinámica foi fundamental pa tresformar la química física nuna ciencia deductiva rigorosa. Mientres el periodu de 1876 a 1878, Gibbs trabayó nos principios de la termodinámica, aplicándolos a los complexos procesos implicaos nes reaiciones químiques. Definió'l conceutu de potencial químicu, o l'enclín de qu'una reaición química prodúzase. En 1876, publicó la so obra más famosa, On the Equilibrium of Heterogeneous Substances (Sobre l'equilibriu de les sustancies heteroxénees), una escoyeta de los sos trabayos de termodinámica y química física na que desenvuelve'l conceutu d'enerxía llibre pa esplicar la base física del equilibriu químicu.[91] Coles ecuaciones de la enerxía llibre, Gibbs rellaciona matemáticamente toles variables arreyaes nuna reaición química (temperatura, presión, volume, enerxía y entropía). Nesti ensayu onde empecipia les sos teoríes sobre les fases de la materia, considera a cada estáu de la materia ye una fase y cada sustancia un componente y rellacionar nuna ecuación, conocida como regla de les fases de Gibbs, que sirve pa determinar los graos de llibertá d'un sistema n'equilibriu. Nesta obra quiciabes la so contribución más destacada ye la introducción del conceutu d'enerxía llibre, polo qu'una de les sos formes denominar anguaño enerxía llibre de Gibbs nel so honor. La enerxía llibre de Gibbs rellaciona l'enclín d'un sistema físicu o químicu a menguar la so enerxía y aumentar el so desorde (entropía) simultáneamente nos procesos naturales bonales. Les conclusiones de Gibbs dexen a los investigadores calcular los cambeos na enerxía llibre d'un procesu, como una reaición química, y determinar la velocidá a la que va asoceder. Como virtualmente tolos procesos químicos y munchos físicos impliquen cambeos d'esti tipu, la so obra tien un impautu significativu tantu nos aspeutos teóricos como esperimentales d'esta ciencia.
En 1877, Ludwig Boltzmann estableció les causes estadístiques de munchos de los conceutos químicos y físicos, incluyida la entropía, y la rellación coles distribuciones de les velocidaes moleculares nun gas.[92] Al pie de Boltzmann y James Clerk Maxwell, Gibbs creó una nueva caña de la física teórica denomada mecánica estadística (términu qu'él acuño), qu'esplica que les lleis de la termodinámica son la consecuencia de les propiedaes estadístiques de grandes conxuntos de partícules n'interaición. Les rellaciones causa-efeutu qu'estableció Gibbs ente les propiedaes estadístiques de los sistemes con munches partícules y les lleis fenomenológicas de la termodinámica (T, p, V, S y O) presentar nel so influyente llibru de testu Elementary Principles in Statistical Mechanics (Principios elementales de mecánica estadística), publicáu en 1902, un añu antes de la so muerte. Nesta obra Gibbs revisa en fondura la rellación ente les lleis de la termodinámica y la teoría estadística del movimientu molecular.
Van't Hoff y Arrhenius[editar | editar la fonte]

En 1873, Jacobus Henricus van 't Hoff y Joseph Achille -y Bel trabayando independientemente desenvolvieron un modelu d'enllaz químicu qu'esplicaba los esperimentos de quiralidad de Pasteur y apurría una causa física pa l'actividá óptica de los compuestos quirales.[93] La publicación de van 't Hoff Voorstel tot Uitbreiding der Tegenwoordige in de Scheikunde gebruikte Structuurformules in de Ruimte (Propuesta pal desenvolvimientu de les fórmules químiques estructurales de tres dimensiones), que constaba de doce páxina de testu y una de diagrames, impulsó'l desenvolvimientu de la estereoquímica. Nesta publicación tratar del conceutu de «átomu de carbonu asimétrico» qu'esplica la esistencia de numberosos isómeros, que nun se podíen esplicar coles fórmules estructurales esistentes hasta entós. Amás señalaba qu'esistía rellación ente l'actividá óptica y esta asimetría del átomu de carbonu. Amás, en 1884 Jacobus Henricus van 't Hoff publicó Études de Dynamique chimique (Estudios de química dinámica), un influyente ensayo sobre cinética química.[94] Nesta obra esplica la rellación termodinámica ente'l calor de reaición y el desplazamientu del equilibriu como resultáu d'una variación de temperatura. A volume constante, l'equilibriu d'un sistema tiende a movese escontra la direición que s'oponga al cambéu de temperatura. Esti principiu sería ampliáu al añu siguiente por Henry Louis Le Châtelier, incluyendo los cambeos de volume y presión. Esta regla denomináu principiu de -y Chatelier, esplica los efeutos qu'exercen les influencies esternes sobre la dinámica del equilibriu químicu.[95]
En 1883, científicu suecu Svante Arrhenius desenvolvió la teoría iónica pa esplicar la conductividá de los electrolitos,[96] suponiendo que dalgunos solutos que n'estáu sólidu yeren neutros componer de partícules cargaes (iones) que compensaben la so carga ente sigo, y que se dixebraben nel senu d'una disolución. En 1885 J. H. van 't Hoff publicó L'Équilibre chimique dans les Systèmes gazeux ou dissous à I'État dilué (Equilibriu químicu en sistemes gaseosos o de soluciones bien esleíes), onde demuestra que la "presión osmótica" nes soluciones que tán abondo esleíes ye proporcional a la concentración y la temperatura absoluto, de forma que esta presión puede espresase por una fórmula que solo s'estrema de la ecuación de presión de los gases nun coeficiente i. Tamién determinó'l valor d'esti i por dellos métodos. Asina van 't Hoff pudo probar que les lleis de la termodinámica pa los gases tamién podíen aplicase a les soluciones esleíes. Amás les sos lleis pa la presión demostraron la validez de la teoría de la disociación electrolítica de Arrhenius.
Descubrimientos de finales del sieglu XIX[editar | editar la fonte]

En 1884, Hermann Emil Fischer propunxo la estructura de la purina, la base de munches biomoléculas, que darréu consiguió sintetizar en 1898. Amás empecipió'l trabayu de la química de la glucosa y otros azucres rellacionaos.[97]
En 1885, Eugene Goldstein dio-y el so nome a los rayos catódicos, y en 1888 siguiendo la so investigación sobre tubos de descarga afayó los rayos canales, lo que darréu ayudaría a desvelar la estructura del nucleu de los átomos.[98]
En 1892, John Strutt (3ᵉʳbarón Rayleigh) afayó que'l nitróxenu que s'atopaba nos compuestos químicos tenía un pesu menor que l'atmosféricu, y supunxo que se trataba porque estos compuestos incluyíen dalgún gas más llixero que menguaba'l pesu total. Sicasí'l químicu escocés William Ramsay atribuyó esta discrepancia a la presencia d'un gas más pesao inda non descubiertu entemecíu col nitróxenu atmosféricu. Usando dos métodos distintos pa esaniciar tolos gases conocíos del aire, Ramsay y Rayleigh consiguieron aisllar un nuevu gas en 1894, y anunciaron qu'afayaren un gas, monoatómico y inerte, que constituyía casi'l 1 % d'aire atmosférico, al que llamaron argón, el primeru de los gases nobles en ser descubiertu. Al añu siguiente Ramsay lliberó otru gas inerte d'un mineral llamáu cleveíta, que resultó ser el heliu, que'l so espectro coincidía col de la lluz solar, lo que demostraba la so presencia nel Sol y determinó que se nomara como la deidá solar griega, Helios. Na so obra The Gases of the Atmosphere (Los gases de l'atmósfera, 1896), Ramsay predixo que según les posiciones del heliu y el argón na tabla periódica esistiríen siquier tres gases nobles más. En 1898 Ramsay y el químicu inglés Morris W. Travers aisllaron estos trés elementos (el neón, kriptón y xenón) a partir del aire llicuao. Darréu (1903) William Ramsay trabayó con Frederick Soddy pa demostrar que les partícules alfa yeren nucleos d'heliu que s'esprendíen de cutio na descomposición del radiu.
En 1893, Alfred Werner afayó la estructura octaédrica de los complexos de cobaltu, el primer complexu de coordinación.[99]
En 1897, Joseph John Thomson afayó'l electrón, usando un tubu de rayos catódicos. En 1898 Wilhelm Wien demostró que los rayos canales (una corriente d'iones positivos) podíen esviase pelos campos magnéticos, y que la esviación yera proporcional a la so rellación masa carga. Esti descubrimientu amás d'ayudar a conocer la estructura del nucleu de los átomos, sería la base pa desenvolver la téunica d'analís químicu denomada espectrometría de mases.[100]
Marie y Pierre Curie[editar | editar la fonte]

Pierre Curie y Marie Curie foi un matrimoniu francu-polacu de científicos famosu pola so investigación pionera nel campu de la radioactividá. Considérase que la investigación que realizaron dambos y Henri Becquerel foi la piedra angular de la era nuclear. Marie quedó estelada cola obra de Becquerel, el físicu francés qu'afayó en 1896 que l'uraniu emitía rayos similares a los rayos X descubiertos por Wilhelm Röntgen. Marie Curie empezó a estudiar l'uraniu a finales de 1897 y teorizó, según un artículu so de 1904: «que la emisión de rayos de los compuestos d'uraniu ye una propiedá del propiu metal, que ye una propiedá atómica del elementu uraniu independiente del so estáu químicu o físicu.» Curie siguió y amplió el trabayu de Becquerel realizando los sos propios esperimentos sobre les emisiones del uraniu. Afayó que les emisiones de rayos yeren constantes, ensin importar la forma o les condiciones en que s'atopara l'uraniu, polo que supunxo que se debíen a la estructura atómica del elementu. Esti descubrimientu supondría l'entamu de la física atómica. Los Curie acuñaron el términu radioactividá pa describir el fenómenu.

Pierre y Marie prosiguieron estudiando les sustancies radiactives dixebrando los presentes en tonelaes de la mena d'uraniu y usando l'electrómetru pa midir la radiación y detectar cualesquier mínima cantidá d'elementos radiactivos, una xera que rique recursos industriales y que ellos consiguieron en condiciones relativamente rudimentaries. Trabayando col pechblenda la pareya afayó un nuevu elementu radiactivu, al que llamaron poloniu, n'honor del país d'orixe de Marie. El 21 d'avientu de 1898, afayaron la presencia d'otru elementu radiactivu na pechblenda, el radiu. Entós la pareya Curie empecipió'l trabayu p'aisllar el poloniu y el radiu de los sos compuestos naturales, pa demostrar que yeren elementos químicos. En 1902, los Curie anunciaron que consiguieren un decigramu de radiu puru. Llevó-yos trés años aisllar el radiu pero nunca fueron capaces d'aisllar el poloniu. Los Curie, xunto a Henri Becquerel, recibieron el Premiu Nobel de Física de 1903 pol so estudiu de la radioactividá. Marie Curie recibió'l Premiu Nobel de Química en 1911 pol descubrimientu del radiu y el poloniu. Por ello Marie Curie foi la primer muyer en recibir un Premiu Nobel, la primer persona en recibir dos Premios Nobel y la única en recibilos en dos disciplines científiques distintes.
Anque Pierre trabayó xunto a Marie na estraición de sustancies de les mines minerales concentrar nel estudiu físicu de la radiación de los nuevos elementos (incluyíos los efeutos químicu y lluminosu). Utilizando campos magnéticos sobre los rayos qu'emitía'l radiu, consiguió demostrar que contenía partícules positives, negatives y radiación ionizante, que Ernest Rutherford darréu denominaría rayu alfa, beta y gamma. Pierre entós estudió estes radiaciones por calorimetría y reparó los efeutos físicos del radiu, abriendo'l camín de la radioterapia, y darréu Marie Curie supervisó los primeros tratamientos de radioterapia contra'l cáncer. Pierre Curie amás estudió'l magnetismu y afayó que les sustancies ferromagnetiques pierden les sos propiedaes magnétiques percima d'una temperatura crítico, denomada temperatura de Curie. Lamentablemente finó tempranamente en 1906 atropelláu por un carruax en París. Les sos obres completes publicar en 1908.
Sieglu XX: revélase la estructura del átomu[editar | editar la fonte]

A principios d'esti sieglu surden dellos modelos atómicos que trataríen de desaniciar los defectos de la teoría atómica de Dalton, que se basaron en gran midida nos datos acumulaos pola espectroscopía y los esperimentos con tubo de descarga na última parte del sieglu anterior. N'afayando la esistencia de los electrones, en 1903 el primeru n'ellaborar un nuevu modelu atómicu foi J. J. Thomson que propunxo que los electrones distribuyíense uniformemente nel interior del átomu suspendíos nuna nube de carga positiva, polo qu'a la so teoría denominar modelu del budín de pases. En 1904 el físicu xaponés Hantaro Nagaoka propunxo unu modelu atómicu orbital con un nucleu trupo y macizo.[101]

En 1903, el botánicu rusu Mikhail Tsvet inventó la cromatografía, una téunica trascendental pa la química analítica, col enfotu de dixebrar sustancies conteníes nes plantes. La cromatografía ye un métodu físicu pa dixebrar amiestos complexos que se basa'l principiu de retención selectiva, yá que diferencies sutiles nel coeficiente de partición de los compuestos da como resultáu una retención diferencial sobre una fase estacionaria y por tanto una separación efeutiva, lo que dexa identificar y determinar les cantidaes de dichos componentes.
En 1905, Fritz Haber y Carl Bosch desenvolvieron el procesu d'Haber pa fabricar a escala industrial amoniacu, un finxu na industria químico con grandes consecuencies na producción de fertilizantes y de munición. Anguaño la producción d'alimentos de la metá de la población del mundu depende d'esti métodu pa la producción de fertilizantes. Haber, xunto a Max Born, propunxo'l ciclu de Born-Haber pa calcular la enerxía reticular na formación de compuestos cristalinos iónicos. Amás Haber ye consideráu'l padre de la guerra química» pol desenvolvimientu de gases tóxicos que s'usaríen na Primer Guerra Mundial.
En 1905, Albert Einstein esplicó'l movimientu browniano de forma que sofitaba definitivamente la teoría atómica. En 1907, Leo Baekeland inventó la baquelita, el primer plásticu que se comercializó con ésitu.
En 1909, el físicu d'Estaos Xuníos Robert Andrews Millikan (discípulu de Walther Nernst y Max Planck) midió con gran precisión la carga individual del electrón, col so famosu esperimentu de les gotes d'aceite, y consiguió confirmar que tolos electrones teníen la mesma carga y masa. Y el mesmu añu S. P. L. Sørensen inventó'l conceutu de pH y desenvolvió métodos pa midir l'acidez.
En 1911, Antonius Van den Broek propunxo la idea que los elementos de la tabla periódica ordenar según les cargues positives del so nucleu, en llugar de pol so pesu atómicu. En 1911 realizóse'l primera Congresu Solvay en Bruxeles cola asistencia de los químicos y físicos más prominentes de la dómina. En 1912 William Henry Bragg y William Lawrence Bragg propunxeron la llei de Bragg que creó'l campu de la cristalografía de rayos X, fundamental pa estudiar la estructura cristalina de les sustancies químiques. Tamién en 1912 Peter Debye desenvolvió'l conceutu de dipolo molecular pa describir la distribución asimétrica de carga de delles molécules.

Enriba: la resultancia prevista si fuera válidu'l modelu atómicu de Thomson. Embaxo: la resultancia del esperimentu que demostró la esistencia d'un nucleu central positivu nel átomu.
Ernest Rutherford y el so modelu atómicu[editar | editar la fonte]

El físicu d'orixe neozelandés Ernest Rutherford ye consideráu'l padre de la física nuclear. Estudió y clarificó la naturaleza de les partícules radioactives, amás de da-yos nome (rayos α, β y γ) demostrando que los dos primeres yeren emisiones de partícules ente que los rayos gamma yeren radiación electromagnético d'alta enerxía. En 1901 y 1902, Rutherford trabayó xunto a Frederick Soddy, pa esplicar que la radioactividá yeren emisiones debíes a la transmutación de los átomos, lo que güei conocemos como reaiciones nucleares. Demostraron esperimentalmente que los átomos radiactivos convertíense bonalmente n'otros, espulsando porciones del átomu a gran velocidá. Tamién reparó que la intensidá de la radioactividá de les muestres de los elementos radiactivos escai con un patrón regular y propio hasta llegar a la estabilidá, y denominó a la metá d'esti tiempu periodu de semidesintegración.
En 1906, Rutherford dirixó un esperimentu realizáu polos sos alumnos Hans Geiger (darréu conocíu pol contador Geiger) y Ernest Marsden na Universidá de Mánchester. Nesti célebre esperimentu, conocíu como'l esperimentu de Rutherford o esperimentu Geiger-Marsden, se bombardeó una perfina llámina d'oru con un fexe de partícules alfa, xeneraes pola descomposición del radón. L'oxetivu del esperimentu yera evaluar la validez del modelu atómicu de Thomson. Si los átomos d'oru afacer a esti modelu les partícules α travesar ensin esviase o faciéndolo pocos graos. Pero los resultaos reales sorprendieron a Rutherford. Anque munches partícules α pasaben ensin esviase, un pequeñu porcentaxe sufría grandes esviaciones, inclusive de más de 90 graos. Esto demostraba que nel interior de los átomos había una masa relativamente grande con carga positiva, a la que darréu Rutherford denominó nucleu atómicu, cola que topetaben les partícules α; y refutaba por completu'l modelu de Thomson. A partir d'estos resultaos Ernest Rutherford desenvolvió el so propiu modelu atómicu, según el cual l'átomu taba constituyíu por un nucleu central positivu relativamente grande con electrones xirando al so alredor como nun sistema planetariu, anque la mayor parte del átomu taba vacida (la mayoría de les partícules α nun atopaben nada con qué topetar). Rutherford foi gallardoniáu col premiu Nobel de química en 1908 polos sos estudios sobre la radioatividad y l'estructura del átomu.

Modelu atómicu de Bohr[editar | editar la fonte]
A pesar de la so gran meyora, el modelu atómicu de Rutherford presentaba un fallu teóricu importante que los físicos nun tardaron en señalar. Según la teoría electromagnética clásica una carga xirando circularmente emitiría enerxía, lo que provocaría que los electrones perdieren enerxía pola emisión y terminaren trazando una espiral hasta bastiase sobre'l nucleu; polo que los átomos nun podríen ser estables asina descritos.[102] En 1913, el físicu danés Niels Bohr iguó esti defectu introduciendo'l conceutu de cuantización na estructura del átomu, al proponer n'el so modelu atómicu que los electrones nun xiraben en cualquier órbita, sinón que tienen acutáu'l so movimientu a órbites de determinaos niveles (aquellos que'l so momentu angular fuera un múltiplu enteru d'h/2π) les cualos seríen órbites estacionaries, que nun emitiríen enerxía.[102]

Nel modelu de Bohr los electrones xiren n'órbites circulares alredor del nucleu en niveles cuantizados, esto ye, solo determinaos radios taben dexaos. Les órbites entemedies nun esisten y los electrones emiten o absuerben enerxía pa pasar a órbites más baxes o altes, respeutivamente. Como los electrones solo atópense en determinaes órbites carauterístiques de cada átomu, la magnitú de los saltos d'enerxía que dan al ser escitaos son únicos pa cada elementu, y seríen los que recueyen los espectro atómicos. El gran ésitu d'esti modelu foi que les llinies del espectru d'emisión esperimental del hidróxenu coincidíen perfectamente colo predicho por él. El modelu atómicu de Bohr supunxo un gran progresu, pero foi criticáu por nun esplicar la causa de la cuantización (plantegar como un postuláu) y el so ésitu colos espectros atómicos amenorgar al hidróxenu y los iones con un solu electrón, nun ye capaz de predicir les interaiciones más complexes n'átomos con más d'un electrón.
Neils Bohr amás trabayó nel principiu de complementariedá qu'afirma que'l comportamientu del electrón puede interpretase de dos formes válides, como una onda o como una partícula, o lo que ye lo mesmo que les teoríes corpuscular y ondulatorio de la lluz nun s'esclúin sinón que se complementen.
Isótopos, protones, neutrones y modelu de Sommerfeld[editar | editar la fonte]

En 1913 Henry Moseley, trabayando sobre la idea inicial de Van den Broek, introdució'l conceutu de númberu atómicu pa iguar los desaxustes de la tabla periódica de Mendeléyev, que se basaba nel pesu atómicu. Tamién en 1913 J. J. Thomson amplió la obra de Wien demostrando que les partícules subatómiques podíen dixebrase según la so rellación carga masa, con una téunica denomada espectrometría de mases. El mesmu añu Frederick Soddy formuló'l conceutu d'isótopu, afirmando qu'esistíen ciertos elementos con dos o más formes, con idéntiques propiedaes químiques, pero distintu pesu atómicu (contradiciendo'l 2ᵘ postuláu de Dalton). Amás en 1917 Soddy afayó l'elementu protactiniu.
Nel añu 1918, Ernest Rutherford afayó que cuando se disparaben partícules alfa contra'l nitróxenu gas, los sos detectores de centelleo captaben nucleos d'hidróxenu, polo que determinó que'l nucleu d'hidróxenu tenía de ser una partícula fundamental, afayando asina'l protón. Amás Rutherford propunxo en 1920 la esistencia de partícules neutres nel nucleu pa esplicar que los nucleos non se desintegrasen pola repulsión electromagnética de los protones.[104] Y finalmente James Chadwick nel añu 1932 afayó una partícula nuclear de masa similar al protón pero de carga neutra, al que denominó neutrón.[105] Esti descubrimientu esplicaba los desaxustes de la tabla periódica de Mendeléyev (la presencia de neutrones podía aumentar el pesu atómicu, pero non la carga del nucleu nin el so númberu atómicu), xustificando asina'l cambéu de Henry Moseley, y tamién la esistencia de los isótopos (los isótopos teníen el mesmu númberu de protones pero distintu de neutrones).
En 1916, Arnold Sommerfeld perfeccionó'l modelu atómicu de Bohr col modelu atómicu de Sommerfeld, qu'introdució les órbites elíptiques con un nuevu númberu cuánticu, el azimutal, y postulando que non solo l'electrón movíase sinón que tamién el nucleu xiraba alredor del centru de mases.
En 1931, Harold Clayton Urey detectó per primer vegada unu de los isótopos más destacaos, el deuteriu o hidróxenu pesáu.[106]
Gilbert N. Lewis[editar | editar la fonte]
El físicu químicu d'Estaos Xuníos Gilbert Newton Lewis empecipió la teoría del enllaz de valencia. Esta teoría basar en que los enllaces químicos dependen de la cantidá d'electrones que tengan los átomos na so capa más esterna, o capa de valencia. En 1902, mientres Lewis intentaba esplicar la valencia a los sos alumnos, representó los átomos como si fueren cubos colos electrones nos vértices. Estos átomos cúbicos» sirvíen pa esplicar los ocho grupos de la tabla periódica y representaben la idea de que los enllaces químicos formábense por que los átomos tresfiriérense electrones unos a otros con oxetu de completar los ocho electrones esteriores, un octeto, necesarios p'algamar la estabilidá al consiguir la mesma configuración electrónica esterior qu'un gas noble.

La teoría de Lewis del enllaz químicu siguió evolucionando y en 1916 publicó'l so influyente artículu The Atom of the Molecule (l'átomu de la molécula), onde propunxo qu'un enllaz químicu formar pola interaición conxunta de dos electrones compartíos. El modelu de Lewis identificaba l'enllaz químicu clásicu cola compartición d'un par d'electrones ente los dos átomos enllazaos. Lewis introdució nesti artículu les diagrames d'electrones de puntos» pa representar les estructures electróniques de los átomos y les molécules qu'anguaño se conocen como estructures de Lewis, que s'usen práuticamente en tolos llibros de testu d'introducción a la química.
Poco dempués de la publicación d'esti artículu de 1916, Lewis empezó a dedicase a la investigación militar. Nun volvió al campu del enllaz químicu hasta 1923, cuando resumió magistralmente el so modelu na obra titulada Valence and the Structure of Atoms and Molecules (Valencia y l'estructura d'átomos y molécules). Esti anováu interés pola materia foi promovíu poles actividaes del químicu d'Estaos Xuníos Irving Langmuir, investigador de General Electric, qu'ente 1919 y 1921 popularizó y desenvolvió el modelu de Lewis. Darréu Langmuir acuñó'l términu enllaz covalente. En 1921, Otto Stern y Walther Gerlach estabecieron el conceutu mecánicu cuánticu de spin pa les partícules subatómiques, que sofitaba la idea de pares d'electrones.
Lewis desenvolvió en 1923 la teoría del par d'electrones llibres pa los ácidos y bases. Lewis redefinió'l conceutu d'ácidu p'amplialo a cualquier átomu o molécula con un octeto incompletu capaz d'aceptar un par d'electrones. Y en contrapartida, les bases seríen cualquier sustancia cola so octeto completu y un par d'electrones llibres d'enllaz que pueda actuar como donante a un ácidu. Los ácidos y bases d'esta teoría conócense como ácidos y bases de Lewis. En 1923, G. N. Lewis y Merle Randall publicaron Thermodynamics and the Free Energy of Chemical Substances (Termodinámica y la enerxía llibre de les sustancies químiques), el primer tratáu de termodinámica química modernu.
Na década de 1920, adoptóse rápido'l modelu de Lewis de los pares d'electrones principalmente nos campos de la química orgánica y la coordinación. En química orgánica esta aplicación débese principalmente al llabor de los químicos británicos Arthur Lapworth, Robert Robinson, Thomas Lowry y Christopher Ingold; ente que nel campu de la química de la coordinación el modelu de Lewis foi promocionáu poles obres del químicu d'Estaos Xuníos Maurice Huggins y el británicu Nevil Sidgwick.
Mecánica cuántica[editar | editar la fonte]
| De izq. a dcha. y de riba a embaxo: Louis de Broglie (1892-1987). Wolfgang Pauli (1900-1958). Erwin Schrödinger (1887-1961). Werner Heisenberg (1901-1976). |
Na década de 1920 van establecese los fundamentos de la mecánica cuántica, que va ser decisiva pa la desvelar la naturaleza y el comportamientu de les partícules subatómiques a partir d'entós.
En 1924, el físicu Louis de Broglie publicó la so revolucionaria tesis, na que presentó la teoría de que l'electrón portar con una dualidad onda partícula. Na so dómina considerábase que les ondes y los corpúsculos de materia y lluz portar de forma distinta, pero de Broglie suxurió qu'estes carauterístiques aparentemente distintes en realidá son el mesmu comportamientu reparáu dende perspectives distintes — que les partícules pueden portase como ondes, y que les ondes (la radiación) pueden portase como les partícules. La propuesta de Broglie ufiertaba una esplicación a les restricciones de movimientu de los electrones nel interior del átomu. Les primeres publicaciones cola idea d'ondes materiales” de De Broglie espertaron poca atención ente los físicos de la dómina, pero una copia de la so tesis doctoral cayó en manes d'Albert Einstein, que la recibió con entusiasmu. Einstein non solo espublizar sinón que trabayó pa desenvolver el conceutu.
En 1925, el físicu austriacu Wolfgang Pauli estableció'l principiu d'esclusión de Pauli, qu'afirmaba que dos electrones alredor del mesmu nucleu nun pueden ocupar el mesmu estáu cuánticu simultáneamente, que ta definíu por cuatro númberos cuánticos. Pauli fixo importantes contribuciones nos campos de la mecánica cuántica y teoría cuántica. Foi gallardoniáu col premiu Nobel de física 1945 pol so descubrimientu del principiu d'esclusión, amás de polos sos estudios del estáu sólidu y la so hipótesis antemanando la esistencia del neutrín.
Ecuación xeneral de Schrödinger pa una onda estacionaria:

En 1926, a la edá de 39 años, el físicu teóricu Erwin Schrödinger creó la obra considerada la pilastra de la mecánica cuántica ondulatoria. Nesta obra describe la so ecuación de diferenciales parciales que ye la ecuación básica de la mecánica cuántica y que supón pa la mecánica del átomu lo mesmo que les lleis de Newton supunxeron pa la comprensión del movimientu de los planetes. Adoptando la propuesta de Louis de Broglie en 1924 de que la materia tien una naturaleza dual y qu'en delles situaciones pórtense como les ondes, Schrödinger desenvuelve la teoría d'esti comportamientu afigurándolo nuna ecuación d'onda, anguaño conocida como la ecuación de Schrödinger. Les soluciones de la ecuación de Schrödinger, a diferencia de les ecuaciones de Newton, son funciones d'onda que describen la probabilidá de qu'asoceda un fechu físicu. La secuencia de trayectories y posiciones fácilmente visualizables de la mecánica de Newton, na mecánica cuántica reemplazar por una noción más astracta de probabilidáes, lo que la fai más escura y anicia delles paradoxes. Por casu a partir del modelu atómicu de Schrödinger los electrones yá nun se van describir n'órbites alredor del átomu sinón n'orbitales.
El físicu teóricu alemán Werner Heisenberg tamién foi unu de los creadores clave de la mecánica cuántica. En 1925, Heisenberg afayó la manera de formular les ecuaciones de la mecánica cuántica en términos de matrices. Por esti descubrimientu sería gallardoniáu col premiu Nobel de física de 1932, y nel futuru facilitaría'l cálculu computacional. En 1927 publicó'l so principiu d'incertidume, nel que basó'l so pensamientu y pol que ye más famosu. Con él Heisenberg demostró que al estudiar un electrón nun átomu podía determinase la so posición o la so velocidá, pero yera imposible conocer los dos coles mesmes.
En 1928, Paul Dirac formuló la ecuación de Dirac, una ecuación d'onda Teoría de la relatividá relativista pa partícules d'espín ½, como l'electrón, que ye dafechu consistente tanto colos principios de la mecánica cuántica como cola teoría de la relatividá especial, que la so aplicación a los átomos hidroxenoides da llugar al modelu atómicu de Dirac.
Al comprobase que los átomos nun faen honor al so nome (estremar en partes), el comportamientu ondulatoriu de les partícules subatómiques y la potencialidá enerxética de les reaiciones nucleares redefiniríase l'ámbitu de la química (como única ciencia qu'estudiaba la materia) quedando l'estudiu de la estructura del interior d'átomu nel campu de la física.
Química cuántica[editar | editar la fonte]
Una vegada asumíos los principios de la mecánica cuántica surde la química cuántica p'aplicalos al estudiu de los enllaces químicos y de les estructures de les molécules y estructures cristalines. Dalgunos consideren que la química cuántica nació en 1926 cola ecuación de Schrödinger y la so aplicación al átomu d'hidróxenu, ente qu'otros consideren qu'arrinca en 1927 col artículu «Wechselwirkung neutraler Atome und Homöopolare Bindung nach der Quantenmechanik» («La interaición de los átomos neutros y l'enllaz homopolar según la mecánica cuántica») de Walter Heitler y Fritz London[107][108] Esta ye la primer aplicación de la mecánica cuántica a la molécula d'hidróxenu y al fenómenu del enllaz químicu. Nos años siguientes fuéronse atropando progresos colos trabayos d'Edward Teller, Friedrich Hund, Robert S. Mulliken, Max Born, J. Robert Oppenheimer, Linus Pauling, Erich Hückel, Douglas Hartree, Vladimir Aleksandrovich Fock, ente otros, que resolvieron que les propiedaes químiques taben determinaes poles estructures electróniques de los átomos y los sos compuestos.

Sicasí, alredor de 1930, calteníase l'escepticismu sobre la capacidá de la mecánica cuántica pa resolver sistemes químicos más complexos por cuenta de les sos dificultaes práutiques. Paul Dirac describe la situación:[109]
Les lleis físiques subxacentes necesaries para [desenvolver] la teoría matemática d'una gran parte de la física y tola química son por tanto dafechu conocíes, y la dificultá ta solo en que l'aplicación exacta d'estes lleis conduz a ecuaciones demasiáu complicaes pa poder resolvese. Por ello ye deseable que se desenvuelvan métodos práuticos averaos d'aplicación de la mecánica cuántica, que puedan conducir a la esplicación de les principales carauterístiques de los sistemes atómicos complexos ensin demasiaos cálculos.

En 1951, publicóse un artículu trascendental pa la química cuántica «A Study of Two-Center Integrals Useful in Calculations on Molecular Structure» («Un estudiu sobre integrales de dos centros útiles pa los cálculos d'estructura molecular») de Clemens C. J. Roothaan sobre les ecuaciones de Roothaan.[110] qu'abrió'l camín pa la solución de les ecuaciones de campu autoconsistente pa molécules pequeñes como les del hidróxenu y nitróxenu. Estos cálculos realizar cola ayuda de tables d'integrales que se calculaben colos ordenadores más avanzaos de la dómina. Les posteriores meyores de la informática facilitaríen el resolución y representación de les complicaes ecuaciones d'onda resultantes.
La teoría de los orbitales moleculares (TOM) desenvolver nos años posteriores a que s'estableciera la teoría del enllaz de valencia, alredor de 1927, principalmente obra de Friedrich Hund, Robert Mulliken, John C. Slater y John Lennard-Jones.[111] La TOM orixinalmente denominóse teoría Hund-Mulliken.[112] El términu orbital foi introducíu por Mulliken en 1932.[112] Alredor de 1933 la TOM fuera aceptada generalizadamente como válida.[113]
Nos años 1940 munchos físicos dedicaos a la física molecular y atómico pasar al campu de la física nuclear (como J. Robert Oppenheimer o Edward Teller). Nesta dómina destaquen los trabayos del químicu d'Estaos Xuníos Glenn T. Seaborg aisllando ya identificando elementos transuránicos, siendo'l coodescubridor de 10 d'ellos (plutoniu, americiu, curiu, berkeliu, californiu, einsteniu, fermiu, mendeleviu, nobeliu y seaborxu). Compartió'l Nobel de química de 1951 con Edwin Mattison McMillan polos sos respeutivos descubrimientos d'elementos transuránicos. El seaborxu recibió esti nome nel so honor en 1997, polo que xunto a Albert Einstein son les úniques persones que recibieron tal honor en vida.
Bioquímica y bioloxía molecular[editar | editar la fonte]
Al empecipiase la década de 1940 l'estensu trabayu coordináu de la química y la física consiguiera esplicar les propiedaes químiques sofitándoles na configuración electrónica del átomu. El llibru de Linus Pauling The Nature of the Chemical Bond (La naturaleza del enllaz químicu, 1939) usa los principios de la química cuántica pa deducir los ángulos de los enllaces en molécules cada vez más complicaes. Sicasí, la complexa estructura de delles de les molécules biolóxicamente más relevantes inda yera desconocida.

Anque la clorofila fuera aisllada en 1817 polos químicos franceses Pelletier y Caventou,[114] la so estructura nun foi deducida hasta 1940 por Hans Fischer. Na década de 1940, el químicu norteamericanu Melvin Calvin empecipió les sos investigaciones sobre la fotosíntesis, aplicando marcadores radiactivos de carbonu 14 y detectó la secuencia de reaiciones químiques xeneraes poles plantes al tresformar dióxidu de carbonu gaseosu y l'agua n'osíxenu y hidratos de carbonu, lo que na actualidá conozse como ciclu de Calvin.
En 1937 Hans Adolf Krebs afayó que toles reaiciones del interior de les célules conocíes arreyaes na respiración celular taben rellacionaes ente sigo, denominando a esta socesión de reaiciones ciclo del ácidu cítrico, más tarde conocíu como ciclu de Krebs. Por esti descubrimientu foi gallardoniáu col premiu Nobel de fisioloxía o medicina de 1953.
La mayoría de los aminoácidos, los componentes de les proteínes, afayar ente 1819 y 1904. En 1926 Theodor Svedberg desenvolvió la primera centrífugadora analítica y utilizar pa calcular el pesu molecular de la hemoglobina. En 1933 Arne Wilhelm Kaurin Tiselius introdució la electroforesis pa dixebrar a les proteínes en solución. En 1934 John Desmond Bernal y Dorothy Crowfoot Hodgkin demostraron que les proteínes, la pepsina en concretu, nun yeren coloides aleatorios una y bones los sos cristales producíen patrones de difraición de rayos X.[115] En 1951 Linus Pauling y Robert Corey propunxeron les estructures de cadena helicoidal (héliz α) y llaminar (llámina β) les cualos fueron topaes darréu en munches proteínes.[116]En 1953 l'esperimentu de Miller y Urey demostró que los aminoácidos, podíen formase a partir de molécules inorgániques simples a partir d'un procesu de estimulación llétricu que podía producise na Tierra, siendo'l primer esperimentu de llaboratoriu en condiciones controlaes sobre hipótesis del orixe de la vida.
Tamién en 1953 James Watson y Francis Crick deducieron la estructura de doble cadena helicoidal del ADN encaxando los datos de la estructura de los sos partes constituyentes y los patrones de difraición de rayos X llograos por Rosalind Franklin.[117] Esti descubrimientu foi'l detonante de la espansión del campu de la bioquímica. En 1957 demostróse'l mecanismu de replicación del ADN por aciu l'esperimentu de Meselson-Stahl. En 1983, Kary Mullis desenvolvió'l métodu pa la autoreplicación del ADN, denomináu reaición en cadena de la polimerasa (conocida poles sos sigles n'inglés como PCR) que revolucionaría'l so procesu químicu de manipulación nos llaboratorios, que fadría posible la secuenciación del ADN de los organismos que remataría nel inmensu Proyeutu Xenoma Humanu, amás d'abrir el so usu en criminalística y filiación, ente otros.

Finales del sieglu XX[editar | editar la fonte]
En 1970, John Pople creó'l programa Gaussian que facilitó descomanadamente los cálculos de la química computacional, como la ecuación de Schrödinger molecular según la teoría d'orbitales moleculares.[118] En 1971 Yves Chauvin presentó una esplicación al mecanismos de reaición de les Metátesis olefínicas.[119] En 1975 Karl Barry Sharpless y el so equipu afayaron les reaiciones d'oxidación estereoselectivas, como la epoxidación de Sharpless,[120][121] la dihidroxilación asimétrica de Sharpless,[122][123][124] y la oxiaminación de Sharpless.[125][126][127]
En 1985, Harold Kroto, Robert Curl y Richard Smalley afayó los fullerenos, una clase de grandes molécules de carbonu con forma de poliedros con cares hexagonales o pentagonales, que'l so nome conmemora al arquiteutu Richard Buckminster Fuller famosu por usar diseños similares nos sos cúpules xeodésiques.[128] En 1991 Sumio Iijima usó'l microscopiu electrónicu p'afayar un tipu de fullereno cilíndricu denomináu nanotubo, anque los primeros trabayos nesti campu realizárense en 1951. Esti material ye un importante componente nel campu de la nanoteunoloxía.[129]
En 1994, Robert A. Holton y el so equipu llograron la primera síntesis total del taxol.[130][131][132]
En 1995, Eric Cornell y Carl Wieman consiguieron producir el primer Entestáu de Bose-Einstein, un estáu d'agregamientu de la materia de ciertos materiales a bien baxes temperatures predichu pola mecánica cuántica que nun tien un equivalente clásicu.[133]
Ver tamién[editar | editar la fonte]
Hestories y cronoloxíes[editar | editar la fonte]
- Cronoloxía de la química
- Descubrimientu de los elementos químicos
- Historia de la bioquímica
- Historia de la cromatografía
- Historia de la electroquímica
- Historia de la enerxía
- Historia de la física
- Historia de la tabla periódica
- Historia de la teoría molecular
- Historia de la termodinámica
- Premiu Nobel de Química
- Teoría atómica
Químicos eminentes[editar | editar la fonte]
N'orde cronolóxicu:
- Robert Boyle, 1627-1691
- Joseph Black, 1728-1799
- Joseph Priestley, 1733-1804
- Carl Wilhelm Scheele, 1742-1786
- Antoine Lavoisier, 1743-1794
- Alessandro Volta, 1745-1827
- Jacques Charles, 1746-1823
- Claude Louis Berthollet, 1748-1822
- Louis Joseph Gay-Lussac, 1778-1850
- Humphry Davy, 1778-1829
- Jöns Jakob Berzelius, 1779-1848
- Justus von Liebig, 1803-1873
- Louis Pasteur, 1822-1895
- Stanislao Cannizzaro, 1826-1910
- Friedrich August Kekulé von Stradonitz, 1829-1896
- Dmitri Mendeleev, 1834-1907
- Josiah Willard Gibbs, 1839-1903
- Jacobus Henricus van 't Hoff, 1852-1911
- William Ramsay, 1852-1916
- Svante Arrhenius, 185-1927
- Walther Nernst, 1864-1941
- Marie Curie, 1867-1934
- Gilbert N. Lewis, 1875-1946
- Otto Hahn, 1879-1968
- Irving Langmuir, 1881-1957
- Linus Pauling, 1901-1994
- Glenn T. Seaborg, 1912-1999
- Robert Burns Woodward, 1917-1979
- Frederick Sanger, 1918-2013
- Rudolph A. Marcus, 1923
- Elias James Corey, 1928
- Harold Kroto, 1939
- Peter Atkins, 1940-
- Richard Smalley, 1943-2005
Notes[editar | editar la fonte]
- ↑ El cinc yá se conocía en China y la India na Edá Media. Méntase'l metal y dos de los sos menas nel Rasaratna Samuchaya, escritu alredor del sieglu XIII d. C. Nes antigües Grecia y Roma conocíase y usaba el latón (aleación de cinc y cobre), anque se desconocía la so naturaleza.
- ↑ Por cuenta de esta asociación, anguaño l'envelenamientu producíu pol plomu conozse como saturnismo; y el mercuriu adquirió'l so nome definitivu, quedando en desusu'l so nome llatín antiguu hydrargyrum (que procedía del griegu hydrargyros «plata líquido»). Esta tradición influyó nos científicos de los sieglos XIX y XX que nomaron a tres elementos (uraniu, neptuniu y plutoniu) n'honor d'Uranu, Neptunu y Plutón, que nun se conocíen na Edá Media.
- ↑ Según Paul Kraus en Contribution à l'histoire des idées scientifiques dans l'Islam. I. -y corpus des écrits jâbiriens. II. Jâbir et la science grecque (2002):
Pa formase una idea del llugar históricu de la alquimia de Jabir y encarar el problema de les sos fontes, ye aconseyable comparar lo que nos quedó de la lliteratura alquímica n'idioma griegu. Conozse l'estáu deplorable en que llegó hasta nós esta lliteratura. Recoyida polos científicos bizantinos del sieglu X, el corpus de los alquimistas griegos ye un puñáu de fragmentos incoerentes, que se remonten a toles dómines dende'l sieglu terceru hasta'l final de la edá media. (...) Los esfuercios de Berthelot y Ruelle pa poner un pocu d'orde nesta masa de lliteratura dio solo probes resultaos, y los investigadores posteriores, ente ellos en particular Mrs. Hammer-Jensen, Tannery, Lagercrantz, von Lippmann, Reitzenstein, Ruska, Bidez, Festugiere y otros, pudieron sacar en claro solo unos pocos detalles (...) L'estudiu de los alquimistas griegos nun ye bien alentador. Inclusive un exame superficial de los testos griegos amuesa que solo una pequeña parte entamábase en redol a verdaderos esperimentos de llaboratoriu: inclusive nes obres supuestamente dedicaes a les téuniques, nel estáu en que les atopamos anguaño, son palabrería ensin sentíu que refuga cualquier interpretación. (...) Ye distintu na alquimia de Jabir. La descripción de los procesos ye relativamente clara y l'instrumentación alquímica, y la clasificación metódica de les sustancies, indica un espíritu esperimental bien alloñáu del esoterismu raru y chambón de los testos griegos. La teoría na que Jabir sofita les sos operaciones ye d'una claridá y una unidá impresionante. Más qu'otru autores n'árabe, unu nota l'equilibriu ente la enseñanza teórico y práctico, ente'l `ilm y el `amal. Buscaríase en devanéu una obra tan sistemática ente los testos griegos como por casu el Llibru del los Setenta.
(vease tamién: Ahmad Y Hassan. «A Critical Reassessment of the Geber Problem: Part Three». Archiváu dende l'orixinal, el 3 d'avientu de 2015. Consultáu'l 9 d'agostu de 2008.
Referencies[editar | editar la fonte]
- ↑ Selected Classic Papers from the History of Chemistry
- ↑ Bowman DM, Balch JK, Artaxo P et al. «Fire in the Earth system.» Science. 2009;324(5926):481-4. doi:10.1126/science.1163886. PMID 19390038. Bibcode:2009Sci...324..481B.
- ↑ «History of Gold». Gold Digest. Consultáu'l 4 de febreru de 2007.
- ↑ Photos, E., «The Question of Meteorictic versus Smelted Nickel-Rich Iron: Archaeological Evidence and Esperimental Results.» World Archaeology Vol. 20, Non. 3, Archaeometallurgy (febreru 1989), páxs. 403-421. Versión en llinia. Consultáu'l 8 de febreru de 2010.
- ↑ Heskel, Dennis L. (1983). «A Model for the Adoption of Metallurgy in the Ancient Middle East». Current Anthropology 24 (3): páxs. 362-366. doi:.
- ↑ «On the origins of extractive metallurgy: New evidence from Europe». Journal of Archaeological Science 37 (11): páxs. 2775. 2010. doi:.
- ↑ Neolithic Vinca was a metallurgical culture Stonepages from news sources November 2007
- ↑ Margueron, 2002, «Los primeros usos de los metales».
- ↑ Archaeomineralogy, p. 164. George Robert Rapp, Springer, 2002.
- ↑ Understanding materials science, p. 125., Rolf Y. Hummel, Springer, 2004.
- ↑ Akanuma, H. (2005). «The significance of the composition of excavated iron fragments taken from Stratum III at the site of Kaman-Kalehöyük, Turkey». Anatolian Archaeological Studies 14: páxs. 147-158.
- ↑ «Ironware piece unearthed from Turkey found to be oldest steel». The Hindu (Chennai, India). 26 de marzu de 2009. http://www.hindu.com/thehindu/holnus/001200903261611.htm. Consultáu'l 27 de marzu de 2009.
- ↑ Tewari, Rakesh (Direutor, O.P. State Archaeological Department). «The origins of Iron Working in India: New evidence from the Central Ganga plain and the Eastern Vindhyas.»
- ↑ Duncan Y. Miller y N. J. van der Merwe, «Early Metal Working in Sub Saharan Africa.» Journal of African History 35 (1994) 1-36; Minze Stuiver y N. J. van der Merwe, «Radiocarbon Chronology of the Iron Age in Sub-Saharan Africa.» Current Anthropology 1968.
- ↑ McIntosh, Roderick J. «How Old is the Iron Age in Sub-Saharan Africa?» Archaeological Institute of America (1999)
- ↑ Alpern, Stanley B. (2005) «Iron in Sub-Saharan Africa.»
- ↑ Higham, Charles. 1996. The Bronze Age of Southeast Asia.
- ↑ mexar Cinco uso históricos de la orina en Quo.
- ↑ Willcox, Michael (2000). «Soap», Hilda Butler: Poucher's Arumes, Cosmetics and Soaps, 10th, Dordrecht: Kluwer Academic Publishers, páx. 453. ISBN 0-7514-0479-9. «The earliest recorded evidence of the production of soap-like materials dates back to around 2800 BCE in ancient Babylon.»
- ↑ G. Y. R. Lloyd (1968). Aristotle: The Growth and Structure of his Thought, páx. 133-139. ISBN 0-521-09456-9.
- ↑ 21,0 21,1 21,2 Will Durant (1935), Our Oriental Heritage: The Story of Civilization, Vol I
- ↑ Simpson, David (29 de xunu de 2005). «Lucretius (99 - 55 e.C. aprox.)». The Internet History of Philosophy. Consultáu'l 9 de xineru de 2007.
- ↑ Lucretius (50 BCE). «de Rerum Natura (Sobre la naturaleza de les coses)». The Internet Classics Archive. Massachusetts Institute of Technology. Consultáu'l 9 de xineru de 2007.
- ↑ Holmyard, Y.J. (1957). Alchemy. New York: Dover, 1990, páx. 15, 16.
- ↑ William Royall Newman. Atoms and Alchemy: Chymistry and the esperimental origins of the scientific revolution. University of Chicago Press, 2006. p. xi.
- ↑ Holmyard, Y.J. (1957). Alchemy. New York: Dover, 1990, páx. 48, 49.
- ↑ Stanton J. Linden. The alchemy reader: from Hermes Trismegistus to Isaac Newton Cambridge University Press. 2003. p.44
- ↑ «The Mineral Exhalation Theory of Metallogenesis in Pre-Modern Mineral Science». Ambix 53: páxs. 43. 2006. doi:.
- ↑ Clulee, Nicholas H. (1988). John Dee's Natural Philosophy. Routledge, páx. 97. ISBN 978-0-415-00625-5.
- ↑ Strathern, 2000. Páxina 79.
- ↑ «The History of Ancient Chemistry.»
- ↑ Derewenda, Zygmunt S. (2007). «On wine, chirality and crystallography». Acta Crystallographica Section A: Foundations of Crystallography 64 (Pt 1): páxs. 246-258 [247]. doi:. PMID 18156689. Bibcode: 2008AcCrA..64..246D.
- ↑ John Warren (2005). «War and the Cultural Heritage of Iraq: a sadly mismanaged affair.» Third World Quarterly, Volume 26, Issue 4 & 5, páxs. 815-830.
- ↑ Dr. A. Zahoor (1997), JABIR IBN HAIYAN (Jabir), University of Indonesia
- ↑ Paul Vallely, How Islamic inventors changed the world, The Independent
- ↑ Kraus, Paul, Jâbir ibn Hayyân, Contribution à l'histoire des idées scientifiques dans l'Islam. I. -y corpus des écrits jâbiriens. II. Jâbir et la science grecque,. Cairo (1942-1943). Repr. By Fuat Sezgin, (Natural Sciences in Islam. 67-68), Frankfurt. 2002.
- ↑ Will Durant (1980). The Age of Faith (The Story of Civilization, Volume 4), p. 162-186. Simon & Schuster. ISBN 0-671-01200-2.
- ↑ Strathern, Paul. (2000), Mendeleyev's Dream – the Quest for the Elements, New York: Berkley Books
- ↑ «An Introduction to Islamic Cosmological Doctrines. Conceptions of Nature and Methods Used for Its Study by the Ikhwan Al-Safa'an, Al-Biruni, and Ibn Sina by Seyyed Hossein Nasr». Speculum 40 (4): páxs. 744-746. 1965. doi:.
- ↑ Robert Briffault (1938). The Making of Humanity, p. 196-197.
- ↑ «A 13th-Century Darwin? Tusi's Views on Evolution». Azerbaijan International 9: p. 2. 2001. http://azer.comaiweb/categories/magazine/92_folder/92_articles/92_tusi.html.
- ↑ Brock, William H. (1992). The Fontana History of Chemistry. Londres: Fontana Press, páx. 32-33. ISBN 0-00-686173-3.
- ↑ Brock, William H. (1992). The Fontana History of Chemistry. London, England: Fontana Press. ISBN 0-00-686173-3.
- ↑ Karl Alfred von Zittel (1901) History of Geology and Palaeontology, p. 15.
- ↑ Asarnow, Herman (8 d'agostu de 2005). «Sir Francis Bacon: Empiricism». An Image-Oriented Introduction to Backgrounds for English Renaissance Literature. University of Portland. Consultáu'l 22 de febreru de 2007.
- ↑ Crosland, M. P. (1959). "The use of diagrams as chemical 'equations' in the lectures of William Cullen and Joseph Black." Annals of Science, Vol. 15, Non. 2, Jun.
- ↑ Parkes, G. D.; Mellor, J. W. (1939). Mellor's Modern Inorganic Chemistry. Longman's Green and Co., p. 717.
- ↑ Robert Boyle
- ↑ Acott, Chris (1999). «The diving "Law-ers": A brief resume of their lives.». South Pacific Underwater Medicine Society journal 29 (1). ISSN 0813-1988. OCLC 16986801. http://archive.rubicon-foundation.org/5990. Consultáu'l 17 d'abril de 2009.
- ↑ Levine, Ira. N (1978). "Physical Chemistry" University of Brooklyn: McGraw-Hill
- ↑ Levine, Ira. N. (1978), p. 12 onde apaez la definición orixinal.
- ↑ Ursula Klein (July 2007). «Styles of Experimentation and Alchemical Matter Theory in the Scientific Revolution». Metascience (Springer) 16 (2): páxs. 247-256 [247]. doi:. ISSN 1467-9981
- ↑ James Bryan Conant, ed. The Overthrow of Phlogiston Theory: The Chemical Revolution of 1775–1789. Cambridge: Harvard University Press (1950), 14. OCLC 301515203.
- ↑ Kim, El mio Gyung (2003). Affinity, That Elusive Dream: A Genealogy of the Chemical Revolution. MIT Press. ISBN 978-0-262-11273-4.
- ↑ Pugazhenthy, L (1991) Cinc Handbook: Properties, Processing, and Use In Design 2ª Edición. CRC Press, p. 2 ISBN 143981502X
- ↑ Roberto Moreno. Actes Del II Centenariu de Don Antonio de Ulloa. Escuela d'Estudios Hispanu-Americanos (Conseyu Cimeru d'Investigaciones Científiques), Archivu Xeneral d'Indies. Vol. 380 p. 79 ISBN 8400075234
- ↑ Nordisk familjebok – Cronstedt: "dean moderna mineralogiens och geognosiens grundläggare" = "the modern mineralogy's and geognosie's founder"
- ↑ Kuhn, 53-60; Schofield (2004), 112-13. The difficulty in precisely defining the time and place of the "discovery" of oxygen, within the context of the developing chemical revolution, is one of Thomas Kuhn's central illustrations of the gradual nature of paradigm shifts in The Structure of Scientific Revolutions.
- ↑ «Joseph Priestley». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation. Consultáu'l 22 de febreru de 2007.
- ↑ ITIA Newsletter. International Tungsten Industry Association. June 2005. http://web.archive.org/web/20110721214335/http://www.itia.info/FileLib/Newsletter_2005_06.pdf. Consultáu'l 18 de xunu de 2008.
- ↑ ITIA Newsletter. International Tungsten Industry Association. December 2005. http://web.archive.org/web/20110721214335/http://www.itia.info/FileLib/Newsletter_2005_12.pdf. Consultáu'l 18 de xunu de 2008.
- ↑ Cooper, Alan. «Joseph Black». History of Glasgow University Chemistry Department. University of Glasgow Department of Chemistry. Archiváu dende l'orixinal, el 10 d'abril de 2006. Consultáu'l 23 de febreru de 2006.
- ↑ Seyferth, Dietmar (2001). «Cadet's Fuming Arsenical Liquid and the Cacodyl Compounds of Bunsen». Organometallics 20 (8): páxs. 1488-1498. doi:. http://pubs.acs.org/cgi-bin/abstract.cgi/orgnd7/2001/20/i08/abs/om0101947.html.
- ↑ Partington, J. R. (1989). A Short History of Chemistry. Dover Publications, Inc. ISBN 0-486-65977-1.
- ↑ Lavoisier, Antoine (1743-1794) en Eric Weisstein's World of Scientific Biography. ScienceWorld.
- ↑ Biografíes y Vides. «Alessandro Volta». Consultáu'l 23 de xunu de 2004.
- ↑ Mottelay, Paul Fleury (2008). Bibliographical History of Electricity and Magnetism, Reprint of 1892, Read Books, páx. 247. ISBN 1-4437-2844-6.
- ↑ «Inventor Alessandro Volta Biography». The Great Idea Finder. The Great Idea Finder. Consultáu'l 23 de febreru de 2007.
- ↑ «John Dalton». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation. Consultáu'l 22 de febreru de 2007.
- ↑ Picáu, Ana Beatriz; Álvarez Milton. (2008) Química I. Editor EUNED. p. 108.
- ↑ «Proust, Joseph Louis (1754-1826)». 100 Distinguished Chemists. European Association for Chemical and Molecular Science. Archiváu dende l'orixinal, el 3 d'avientu de 2015. Consultáu'l 23 de febreru de 2007.
- ↑ Enghag, P. (2004). «11. Sodium and Potassium», Encyclopedia of the elements. Wiley-VCH Weinheim. ISBN 3-527-30666-8.
- ↑ Davy, Humphry (1808). «On some new Phenomena of Chemical Changes produced by Electricity, particularly the Decomposition of the fixed Alkalies, and the Exhibition of the new Substances, which constitute their Bases». Philosophical Transactions of the Royal Society of London (Royal Society of London.) 98 (0): páxs. 1-45. doi:. https://books.google.com/?id=Kg9GAAAAMAAJ.
- ↑ Weeks, Mary Elvira (1933). «XII. Other Elements Isolated with the Aid of Potassium and Sodium: Beryllium, Boron, Silicon and Aluminum», The Discovery of the Elements. Easton, PA: Journal of Chemical Education. ISBN 0-7661-3872-0.
- ↑ Robert E. Krebs (2006). The history and use of our earth's chemical elements: a reference guide. Greenwood Publishing Group, páx. 80. ISBN 0-313-33438-2.
- ↑ Sir Humphry Davy (1811). «On a Combination of Oxymuriatic Gas and Oxygene Gas». Philosophical Transactions of the Royal Society 101 (0): páxs. 155-162. doi:. http://www.chemteam.info/Chem-History/Davy-Chlorine-1811.html.
- ↑ 77,0 77,1 Courtois, Bernard (1813). «Découverte d'une substance nouvelle dans le Vareck». Annales de chimie 88: p. 304. https://books.google.com/books?id=YGwri-w7sMAC&pg=RA2-PA304.
- ↑ Swain, Patricia A. (2005). «Bernard Courtois (1777–1838) famed for discovering iodine (1811), and his life in Paris from 1798». Bulletin for the History of Chemistry 30 (2): p. 103. http://www.scs.uiuc.edu/~mainzv/HIST/awards/OPA%20Papers/2007-Swain.pdf.
- ↑ 79,0 79,1 Gay-Lussac, J. (1813). «Sur un nouvel acide formé avec la substance décourverte par M. Courtois». Annales de chimie 88: p. 311. https://books.google.com/books?id=YGwri-w7sMAC&pg=RA2-PA511.
- ↑ Gay-Lussac, J. (1813). «Sur la combination de l'iode avec d'oxigène». Annales de chimie 88: p. 319. https://books.google.com/books?id=YGwri-w7sMAC&pg=RA2-PA519.
- ↑ Gay-Lussac, J. (1814). «Mémoire sur l'iode». Annales de chimie 91: p. 5. https://books.google.com/books?id=Efms0Fri1CQC&pg=PA5.
- ↑ Davy, H. (1813). «Sur la nouvelle substance découverte par M. Courtois, dans le sel de Vareck». Annales de chimie 88: p. 322. https://books.google.com/books?id=YGwri-w7sMAC&pg=RA2-PA522&lpg=RA2-PA522.
- ↑ Davy, Humphry (1 de xineru de 1814). «Some Experiments and Observations on a New Substance Which Becomes a Violet Coloured Gas by Heat». Phil. Trans. R. Soc. Lond. 104: p. 74. doi:.
- ↑ Gay-Lussac, J. L., Recherches sur la dilatation des gaz et des vapeurs, 43, https://books.google.com/books?id=Z6ctSn3TIeYC&pg=PA137#v=onepage&q&f=false. English translation (extract).
Na páxina 157, Gay-Lussac menta los afayos ensin publicar de Charles: Avant d'aller plus loin, je dois prévenir que quoique j'eusse reconnu un grand nombre de fois que les gaz oxigène, azote, hydrogène et acide carbonique, et l'air atmosphérique se dilatent également depuis 0° jusqu'a 80°, Le cit. Charles avait remarqué depuis 15 ans la même propriété dans ces gaz ; mais n'avant jamais publié ses résultats, c'est par le plus grand hasard que je les ai connus. (Antes d'avanzar, tendría d'informar qu'anque yo reconocí munches vegaes que los gases osíxenu, nitróxenu, hidróxenu, y ácidu carbónico [dióxidu de carbonu], amás del aire atmosférico espandir dende 0° a 80°, el ciudadanu Charles diérase cuenta hai 15 años les mesmes propiedaes nos mesmos gases; anque nunca los publicar, que por casualidá conocí.) - ↑ Dalton, J. (1802) "Essay IV. On the expansion of elastic fluids by heat," Memoirs of the Literary and Philosophical Society of Manchester, vol. 5, pt. 2, páxs. 595-602.
- ↑ «Benjamin Silliman, Jr. (1816–1885)». Picture History. Picture History LLC. Consultáu'l 24 de marzu de 2007.
- ↑ «History of Chirality». Stheno Corporation. Archiváu dende l'orixinal, el 7 de marzu de 2007. Consultáu'l 12 de marzu de 2007.
- ↑ «Lambert-Beer Law». Sigrist-Photometer AG (7 de marzu de 2007). Consultáu'l 12 de marzu de 2007.
- ↑ Leicester, Henry M. (1956). The Historical Background of Chemistry. John Wiley and Sons, páx. 191-192. ISBN 0486610535.
- ↑ Moore, F. J. (1931). A History of Chemistry. McGraw-Hill, páx. 182–1184. ISBN 0-07-148855-3. (2ª edición)
- ↑ O'Connor, J. J.. «Josiah Willard Gibbs». MacTutor. School of Mathematics and Statistics University of St Andrews, Scotland. Consultáu'l 24 de marzu de 2007.
- ↑ Weisstein, Eric W.. «Boltzmann, Ludwig (1844–1906)». Eric Weisstein's World of Scientific Biography. Wolfram Research Products. Consultáu'l 24 de marzu de 2007.
- ↑ «Jacobus Henricus van't Hoff». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation. Consultáu'l 22 de febreru de 2007.
- ↑ «Jacobus H. van 't Hoff: The Nobel Prize in Chemistry 1901». Nobel Lectures, Chemistry 1901–1921. Elsevier Publishing Company. Consultáu'l 28 de febreru de 2007.
- ↑ «Henry Louis Le Châtelier». World of Scientific Discovery. Thomson Gale. Consultáu'l 24 de marzu de 2007.
- ↑ «Svante August Arrhenius». Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation. Consultáu'l 22 de febreru de 2007.
- ↑ «Emil Fischer: The Nobel Prize in Chemistry 1902». Nobel Lectures, Chemistry 1901–1921. Elsevier Publishing Company. Consultáu'l 28 de febreru de 2007.
- ↑ «History of Chemistry». Intensive Xeneral Chemistry. Columbia University Department of Chemistry Undergraduate Program. Consultáu'l 24 de marzu de 2007.
- ↑ «Alfred Werner: The Nobel Prize in Chemistry 1913». Nobel Lectures, Chemistry 1901–1921. Elsevier Publishing Company. Consultáu'l 24 de marzu de 2007.
- ↑ «Alfred Werner: The Nobel Prize in Physics 1911». Nobel Lectures, Physics 1901–1921. Elsevier Publishing Company. Consultáu'l 24 de marzu de 2007.
- ↑ B. Bryson (2003). A Short History of Nearly Everything. Broadway Books. ISBN 0-7679-0817-1.
- ↑ 102,0 102,1 M. Diaz Peña y A. Roig Muntaner. Quimica Física 1. Ed. Alambra Universidá. p. 7-25. ISBN 8420509981
- ↑ Akhlesh Lakhtakia (Ed.) (1996). «Models and Modelers of Hydrogen». American Journal of Physics (World Scientific) 65 (9): páxs. 933. doi:. ISBN 981-02-2302-1. Bibcode: 1997AmJPh..65..933L.
- ↑ Y. Rutherford (1920). «Nuclear Constitution of Atoms». Proceedings of the Royal Society A 97 (686): páxs. 374. doi:. Bibcode: 1920RSPSA..97..374R.
- ↑ Chadwick, James (1932). «Possible Existence of a Neutron». Nature 129 (3252): p. 312. doi:. Bibcode: 1932Natur.129Q.312C.
- ↑ «Harold Urey and the discovery of deuterium». Physics Today 35 (9): p. 34. 1982. doi:. Bibcode: 1982PhT....35i..34B.
- ↑ W. Heitler y F. London, «Wechselwirkung neutraler Atome und Homöopolare Bindung nach der Quantenmechanik.» Z. Physik, 44, 455 (1927).
- ↑ Quantum chemistry
- ↑ P.A.M. Dirac, «Quantum Mechanics of Many-Electron Systems», Proc. R. Soc. London, A 123, 714 (1929).
- ↑ C.C.J. Roothaan, «A Study of Two-Center Integrals Useful in Calculations on Molecular Structure.» J. Chem. Phys., 19, 1445 (1951).
- ↑ Coulson, Charles, A. (1952). Valence. Oxford at the Clarendon Press.
- ↑ 112,0 112,1 «Spectroscopy, Molecular Orbitals, and Chemical Bonding» (pdf). Elsevier Publishing Company. Nobel Lectures, Chemistry 1963-1970 (Amsterdam). 1972. http://nobelprize.org/nobel_prizes/chemistry/laureates/1966/mulliken-lecture.pdf.
- ↑ Hall, George G. «Lennard-Jones Paper of 1929 Foundations of Molecular Orbital Theory.». Advances in Quantum Chemistry 22. doi:. ISBN 978-0-12-034822-0. ISSN 0065-3276. Bibcode: 1991AdQC...22....1H. http://www.quantum-chemistry-history.com/LeJo_Dat/LJ-Hall1.htm Lennard-Jones Paper of 1929.
- ↑ Delépine, Marcel (Setiembre 1951). «Joseph Pelletier and Joseph Caventou». Journal of Chemical Education 28 (9): p. 454. doi:. Bibcode: 1951JChEd..28..454D.
- ↑ Donald Voet, Judith G. Voet y Charlotte W. Pratt. Fundamentos De Bioquimica. Ed. Médica Panamericana, p. 130. ISBN 9500623145
- ↑ Alberts, Bray, Hopkin, Johnson, Lewis, Raff, Roberts, Walter. "Introducción a la Bioloxía Celular". Segunda Edición
- ↑ Watson, J. and Crick, F., «Molecular Structure of Nucleic Acids.» Nature, April 25, 1953, p. 737-8.
- ↑ W. J. Hehre, W. A. Lathan, R. Ditchfield, M. D. Newton y J. A. Pople, Gaussian 70 (Quantum Chemistry Program Exchange, Program Non. 237, 1970).
- ↑ «Catalyse de transformation des oléfines par les complexes du tungstène. II. Télomérisation des oléfines cycliques en présence d'oléfines acycliques.» Die Makromolekulare Chemie Volume 141, númberu 1, Fecha: 9 de febreru de 1971, páxs. 161-176 Par Jean-Louis Hérisson, Yves Chauvin doi 10.1002/macp.1971.021410112
- ↑ Katsuki, T.; Sharpless, K. B. J. Am. Chem. Soc. 1980, 102, 5974. (doi 10.1021/ja00538a077)
- ↑ Hill, J. G.; Sharpless, K. B.; Exon, C. M.; Regenye, R. Org. Syn., Coll. Vol. 7, p. 461 (1990); Vol. 63, p.66 (1985). (Article)
- ↑ Jacobsen, Y. N.; Marko, I.; Mungall, W. S.; Schroeder, G.; Sharpless, K. B. J. Am. Chem. Soc. 1988, 110, 1968. (doi 10.1021/ja00214a053)
- ↑ Kolb, H. C.; Van Nieuwenhze, M. S.; Sharpless, K. B. Chem. Rev. 1994, 94, 2483-2547. (Review) (doi 10.1021/cr00032a009)
- ↑ Gonzalez, J.; Aurigemma, C.; Truesdale, L. Org. Syn., Coll. Vol. 10, p.603 (2004); Vol. 79, p.93 (2002). (Article)
- ↑ Sharpless, K. B.; Patrick, D. W.; Truesdale, L. K.; Biller, S. A. J. Am. Chem. Soc. 1975, 97, 2305. (doi 10.1021/ja00841a071)
- ↑ Herranz, Y.; Biller, S. A.; Sharpless, K. B. J. Am. Chem. Soc. 1978, 100, 3596-3598. (doi 10.1021/ja00479a051)
- ↑ Herranz, Y.; Sharpless, K. B. Org. Syn., Coll. Vol. 7, p. 375 (1990); Vol. 61, p. 85 (1983). (Artículu)
- ↑ «The Nobel Prize in Chemistry 1996». Nobelprize.org. The Nobel Foundation. Consultáu'l 28 de febreru de 2007.
- ↑ «Benjamin Franklin Medal awarded to Dr. Sumio Iijima, Direutor of the Research Center for Advanced Carbon Materials, AIST». National Institute of Advanced Industrial Science and Technology. Archiváu dende l'orixinal, el 3 d'avientu de 2015. Consultáu'l 27 de marzu de 2007.
- ↑ «First total synthesis of taxol 1. Functionalization of the B ring.» Robert A. Holton, Carmen Somoza, Hyeong Baik Kim, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith, Soekchan Kim, et al.; J. Am. Chem. Soc.; 1994; 116(4); 1597-1598. DOI Abstract
- ↑ «First total synthesis of taxol. 2. Completion of the C and D rings.» Robert A. Holton, Hyeong Baik Kim, Carmen Somoza, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith, Soekchan Kim, et al. J. Am. Chem. Soc.; 1994; 116(4) pp 1599-1600 DOI Abstract
- ↑ «A synthesis of taxusin.» Robert A. Holton, R. R. Juo, Hyeong B. Kim, Andrew D. Williams, Shinya Harusawa, Richard Y. Lowenthal, Sadamu Yogai J. Am. Chem. Soc.; 1988; 110(19); 6558-6560. Abstract
- ↑ «Cornell and Wieman Share 2001 Nobel Prize in Physics». NIST News Release. National Institute of Standards and Technology. Archiváu dende l'orixinal, el 3 d'avientu de 2015. Consultáu'l 27 de marzu de 2007.
Enllaces esternos[editar | editar la fonte]
- Bertomeu Sánchez, José Ramón; García Belmar, Antonio (2008). «La historia de la química: pequeña guía pa navegantes. Parte I: vieyes y nuevos enclinos». Añales de la Real Sociedá Española de Química 104 (1). ISSN=1575-3417, páxs. 56-63. http://dialnet.unirioja.es/servlet/ficheru_articulo?codigo=2558242&orde=0.
- Bertomeu Sánchez, José Ramón; García Belmar, Antonio (2008). «La historia de la química: pequeña guía pa navegantes. Parte II: llibros, revistes, sociedaes, centros d'investigación y enseñanza». Añales de la Real Sociedá Española de Química 104 (2). ISSN=1575-3417, páxs. 146-153. http://dialnet.unirioja.es/servlet/ficheru_articulo?codigo=2662610&orde=0.
- SHAC: Society for the History of Alchemy and Chemistry

