Sólidu amorfu
| Sólidu amorfu | |
|---|---|
| Sistema cristalín | |
| Estructura cristalina | |
 | |
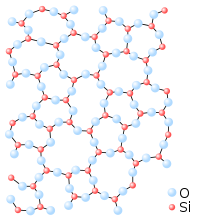

El sólidu amorfu ye un estáu sólidu de la materia, nel que les partícules que conformen el sólidu escarecen d'una estructura ordenada. Estos sólidos escarecen de formes bien definíes. Esta clasificación oldea cola de sólidos cristalinos, que los sos átomos tán dispuestos de manera regular y ordenada formando redes cristalines.
Munchos sólidos amorfos son amiestos de molécules que nun se pueden apilar bien. Casi tolos demás componer de molécules grandes y complexes. Ente los sólidos amorfos más conocíos destaca'l vidru.
Un mesmu compuestu superenfriado, según el procesu de solidificación, puede formar una rede cristalina o un sólidu amorfu. Por casu, según la disposición espacial de les molécules de xil (SiO2), puede llograse una estructura cristalina (el cuarzu) o un sólidu amorfu (el vidru).
Propiedaes de los sólidos amorfos[editar | editar la fonte]
Les molécules de los sólidos amorfos tán distribuyíes al azar lo que se traduz en que les propiedaes físiques macroscópicas del sólidu son isótropas, idéntiques en toles direiciones .
Los sólidos amorfos tienen una temperatura carauterístico a la cual les sos propiedaes esperimenten cambeos importantes. Esta temperatura conozse como temperatura de transición vítrea (Tg). La temperatura de transición a vidru d'un material amorfo puede amenorgase añadiendo molécules pequeñes, denominaes "plastificadores", que s'afaen ente les molécules vítrees y apúrre-yos mayor movilidá.
Una consecuencia direuta de la disposición irregular de les partícules nun sólidu amorfu, ye la diferencia d'intensidá que tomen les fuercies intermoleculares ente les mesmes, d'ende que la fusión s'algame a distintes temperatures, según la proporción de les distintes partícules que formen la muestra. D'ello deduzse qu'un sólidu amorfu nun tien un puntu de fusión definíu, sinón que dicha tresformamientu socede nun intervalu de temperatura. Cuando se calecer un sólidu amorfu, la sustancia nun manifiesten un puntu de fusión, anque s'allandien progresivamente aumentando'l so enclín a deformarse. En contraste, la temperatura de fusión d'un sólidu cristalín ye precisa y ta bien definida. La distribución de los átomos y superficies d'un sólidu ye variada, la distribución de los electrones provoca que les fuercies d'atraición o enllaces tengan delles carauterístiques de cada tipu d'oxetu.
Tocantes a les sos propiedaes elástiques, puede afirmase que los sólidos amorfos manifiesten les propiedaes de los cristales. Por casu, al aplicar una carga a un material amorfo nun intervalu racionado de tiempu, la sustancia va desenvolver una deformación pseudo-permanente, esto ye, va fluyir como si fuera un líquidu de mafa bien alta.
Respectu al magnetismu, los metales amorfos presenten les propiedaes magnétiques más notables, portándose como materiales ferromagnéticos (aquellos nos que se produz un ordenamientu magnéticu de tolos momentos magnéticos na mesma direición y sentíu).
| Sustancia amorfo | Tipu d'enllaz | Tg (K) |
|---|---|---|
| SiO2 | covalente | 1430 |
| GeO2 | covalente | 820 |
| Si, Gue | metálicu | - |
| Pd0.4 Nin0.4 P0.2 | iónicu | 580 |
| BeF2 | covalente | 570 |
| Poliestireno | covalente | 370 |
| Se | covalente | 310 |
| Au0.8 Si0.2 | metálicu | 290 |
| H2O | enllace de H | 140 |
| C2H5OH | enllaz de H | 90 |
| Isopentano | Van der Waals | 65 |
| Fe, Co, Bi | metálicu | - |
Aplicaciones[editar | editar la fonte]
Por cuenta de les sos propiedaes mecániques nun tien la necesidá , hai un gran númberu de sólidos amorfos que s'empleguen como materiales pa la industria y la construcción.
Los óxidos amorfos, gracies a la so tresparencia, solidez y facilidá pa da-y forma en llámines grandes, empléguense profusamente como vidru de ventana. Ciertos polímeros orgánicos, en virtú de la so resistencia y pesu llixeru y fácil procesamientu, empléguense como materiales estructurales (plásticos). Esisten semiconductores amorfos que s'empleguen nes memories d'ordenador y en célules solares gracies a les sos propiedaes óptiques fotovoltaiques y na facilidá pa crear películes delgaes de gran superficie. Los metales amorfos emplegar en nucleos de tresformadores gracies al so ferromagnetismu, baxes perdes y la posibilidá de formar cintes llargues. El calcogenuro amorfu emplegar en xerografía en virtú de la so fotoconductividad y la posibilidá de formar películes de gran área.
Diferencies colos sólidos cristalinos[editar | editar la fonte]
La principal diferencia ente un sólidu cristalín y un sólidu amorfu ye la so estructura. Nun sólidu cristalín esiste una ordenación de los átomos a llargu algame, ente que nos sólidos amorfos nun puede predicise onde se va atopar el próximu átomu. Nesti fechu básense los distintos métodos de diferenciación ente dambos tipos de sólidu, qu'en dellos casos nun ye bono d'establecer a güeyu. Dichos métodos de diferenciación inclúin:
Difracción[editar | editar la fonte]

La difracción consiste n'unviar un fexe de radiación sobre'l sólidu y tomar midíes a distintos ángulos nun ampliu rangu angular, coles mires de deducir la disposición de los átomos nel sólidu oxetu d'estudiu. Los picos qu'apaecen na diagrama de difracción (difractograma), correspuenden a la diferencia constructiva del fexe de radiación con un planu atómicu, esto ye, cuando se cumple la llei de Bragg (dexa estudiar les direiciones nes que la difracción de rayos X sobre la superficie d'un cristal produz interferencies constructives).
Esisten distintos métodos de difracción, que dependen del tipu de sonda unviada escontra la muestra. Los trés tipos de sonda más utilizaos en difracción son los rayos X, los de neutrones y los d'electrones. Les diferencies ente ellos establécense na llonxitúes d'onda y el mecanismu d'interacción. D'estos trés tipos de difracción, la más habitual pal estudiu de los sólidos ye la de rayos X.
Nun sólidu cristalín la disposición de los sos átomos guarda una simetría. Por esa razón, la so diagrama de difracción por rayos X amuesa dellos picos perbién definíos a unos ángulos determinaos. Colos datos de la intensidá y de la posición angular, según les fórmules d'interacción ente rayos X y el sólidu, puede calculase la posición de los átomos nesi sólidu.
Nun sólidu amorfu, los átomos tán asitiaos al azar, por cuenta de lo cual, na so diagrama de difracción reparar pocos picos, polo xeneral unu, que se caracteriza por una gran anchor angular. Analizando l'anchor angular del picu xunto cola intensidá y el tipu d'interacción, puede llograse la función de distribución radial, que da la distancia a primeros vecinos d'atopar un nuevu átomu.
Calorimetría[editar | editar la fonte]
La calorimetría consiste en midir la cantidá de calor captáu o vencíu pol sólidu estudiáu nel momentu de solidificación. Nun sólidu amorfu, la disposición irregular de los sos átomos fai que tenga una alta entropía (altu desorde) con respectu al sólidu cristalín, que ta perfectamente ordenáu. A la de la cristalización, esta alta entropía fai que la variación de calor sía bien nidiu y polo tanto tea bien estendíu nun gran rangu de temperatures. Sicasí, el calor específico del sólidu cristalín mientres la cristalización amuesa un picu estrechu bien definíu a una temperatura concreto, que correspuende a la temperatura de cristalización.
Llogru de sólidos amorfos[editar | editar la fonte]
Los sólidos amorfos pueden formase, en condiciones naturales, si crecen en condiciones onde nun esiste abonda movilidá de los átomos. Nel añu 1969, David Turnbull escribió que "probablemente tolos materiales pueden, si esfrecer cola abonda rapidez y alloñanza de la temperatura crítico, ser camudaos en sólidos amorfos".[1]
Artificialmente, esisten dellos métodos de llogru de sólidos amorfos. El métodu más antiguu y más emplegáu ye'l de la fundición templada, del que se conocen delles variedaes:
Bloque conxeláu[editar | editar la fonte]
Esta téunica precisa d'un altu rangu de temperatures pal enfriamientu y formar una aleación metálica. Un remexu de metal fundíu ye propulsado contra la superficie d'un cilindru de cobre, que s'atopa en rápida rotación, lo qu'obliga al líquidu a esfrecese (a temperatura ambiente o menor). Dientro de la téunica del bloque conxeláu, estremar ente splat-cooling y el templáu xiratoriu d'estracción.
Templáu con líquidu[editar | editar la fonte]
Esta téunica puede ser utilizada pal enfriamientu de líquidos, utilizando baños de xelu nos cualos introdúcense pequeñes cantidaes de fundíu; dexa esfrecer con rangos de velocidá altes.
Templáu al aire[editar | editar la fonte]
Esta téunica puede ser utilizada pa materiales con enclín a la formación de sólidos amorfos. Puede llograse la fundición con enfriamientu lentu, lo cual consíguese apagando'l fornu. Sólidos amorfos llograos por aciu esti métodu son SiO2, As2S3 y poliestireno.
Condensación del vapor[editar | editar la fonte]
Esta téunica empieza cuando'l vapor formáu nuna cámara de vacíu, pola evaporación del material, topeta con una superficie fría, llográndose una sustancia amorfo.
Polímeros[editar | editar la fonte]
Los polímeros son compuestos macromoleculares de cadena llarga, constituyíos principalmente por carbonu (C), hidróxenu (H) y osíxenu (O), anque dacuando pueden presentar F, N, P y S. Son resultáu de la unión de monómeros por aciu la unión d'una reacción química llamada polimerización. La polimerización puede llevase a cabu de forma natural, como asocede coles proteínes, o bien de forma artificial, llográndose materiales plásticos.
Estes macromolécules pueden presentar munches configuraciones y conformances. La configuración referir a diferencies estructurales de curtiu algame y nun puede modificar de forma reversible. Los polímeros tienen estructures pocu compactes debíu al enrollamiento de les cadenes y de la presencia de grupos atómicos llaterales.
Tou lo que contribúi a un probe empaquetamiento, favorez la formación d'una estructura forma, por casu, cadenes moleculares bien llargues y ramificaes, distribución al azar de grupos llaterales grandes a lo llargo de les cadenes, cadenes copoliméricas (formaes por combinación de dos o más monómeros), según la presencia d'aditivos plastificantes que dixebren les cadenes unes d'otres y añader a los plásticos p'ameyorar les sos propiedaes. Los polímeros, que los sos monómeros son verdaderamente senciellos, desenvuelven ciertu grau d'ordenamientu según como s'esfrecieron, pero non tol material cristaliza.
Exemplu de materiales plásticos parcialmente cristalinos son el polietileno, polipropileno isotáctico, náilon, y el politereftalato d'etilenu (PET).
Los materiales camuden les sos propiedaes mecániques según atópense percima o per debaxo de la temperatura de reblandecimiento. Percima, se deforman fácilmente al pasar d'una a otra conformanza, ente que per debaxo tán fixos. Nel material amorfo, les cadenes tán más separaes que na estructura llaminar. Ello refléxase nun amenorgamientu de la densidá.
Según les sos propiedaes, estrémense dellos tipos de polímeros:
- Polímeros termoplásticos, que flúin (pasen al estáu líquidu) al calecer y vuélvense a endurecer al esfrecelos. La so estructura molecular presenta pocos (o nengún) entrecruzamiento.
- Polímeros termoestables, que nun flúin, y lo único que se consigue al calecer ye que se descompongan químicamente. Esti comportamientu deber a una estructura con munchos entrecruzamientos, que torguen los desplazamientos relativos de les molécules
- Elastómeros, qu'amuesen un comportamientu elásticu. Suelen ser termoestables, pero tamién termoplásticos por cuenta de que el enllaz covalente apurre la capacidá de que los monómeros vuelvan a la posición orixinal una vegada déxase d'aplicar la fuercia *
Polímeros espandíos (esplumes). Carauterizar por ser porosos y tener baxa densidá. Llograr por dispersión d'un gas nun polímeru primero que s'endurecer, bien sía termoestable o termoplásticu.
Vidriu[editar | editar la fonte]
El vidru ye un sólidu amorfu cola estructura d'un líquidu. Téunicamente, un vidru ye un productu inorgánicu de la fusión que s'esfreció a una velocidá demasiáu alzada pa dexar la formación de cristales.
Anque popularmente llámase cristal y vidru a un mesmu material, esiste una diferencia esencial ente dambos. El cristal fai referencia a un estáu d'ordenación de la materia que s'atopa na naturaleza en distintes formes (por casu, cuarzu o cristal de roca). El vidru, sicasí, ye la resultancia de la fusión de ciertos ingredientes (xil, carbonatu de sodiu sosa y cal). Esisten, sicasí, vidrios creaos pola naturaleza, como la obsidiana que se forma pol calor xeneráu nel interior de los volcanes. Llámase equivocadamente cristal al vidru de plomu o vidru ópticu, pos la so tresparencia asonsaña al cristal de roca natural; esta imitación fuera siempres la meta principal de los vidreros.
Ver tamién[editar | editar la fonte]
Referencies[editar | editar la fonte]
- ↑ D. Turnbull, "Under what conditions can a glass be formed?," Contemporary Physics 10:473-488 (1969)
