Nilón
| Nilón | |
|---|---|
|
grupo de sustancias químicas (es) | |
|
poliamida (es) | |
 | |
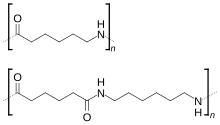
El nilón[1] o nailon[2] (de la marca comercial rexistrada: nylon®) ye un polímeru artificial que pertenez al grupu de les poliamides. Xenérase formalmente por policondensación d'un diácidu con una diamina. La cantidá d'átomos de carbonu nes cadenes de la amina y del ácidu pue indicase darrera de les iniciales de poliamida. El más conocíu, el PA6.6 ye polo tanto'l productu formal del ácidu hexanodioicu (ácidu adípicu) y la hexametilenodiamina.
Por razones práutiques nun s'utiliza l'ácidu y l'amina, sinón soluciones de l'amina y del cloruru del diácidu. Ente los dos fases, fórmase'l polímeru que pue ser espandíu pa dar el filu de nilón.
Un polímeru paecíu ye'l perlón que se forma por apertura y polimerización d'una lactama, xeneralmente la caprolactama. La diferencia ta en que nel nilón les cadenes tán formaes por polímeros de la fórmula de xeneral ( ..-NH-C(=O)-(CH2)n-C(=O)-NH-(CH2)m-...) ente que nel perlón les cadenes tienen la secuencia ( ..-NH-C(=O)-(CH2)n-NH-C(=O)-(CH2)n-...).
El descubridor del nilón y quien lu patentó de primeres foi Wallace Hume Carothers. El descubrimientu foi'l día 28 de febreru de 1935, pero nun foi patentáu hasta'l 20 de setiembre de 1938 (U.S. Patents 2130523, 2130947 et 2130948). A la muerte d'ésti, la empresa DuPont caltuvo la patente. Los Llaboratorios DuPont, en 1938, produxeron esta fibra sintética fuerte y elástica, que trocaría en parte a la seda y el rayón.
El nilón ye una fibra testil elástica y resistente, nun lu ataca'l virugu, nun precisa plancháu y utilízase na confección de medies, texíos y teles de puntu, tamién cerdes y sedales. El nilón moldiáu utilízase como material duro na fabricación de diversos instrumentos, como mangos de cepiyos, peñes, etc.
Con esti inventu, revolucionóse en 1938 el mercáu de les medies, cola fabricación de les medies de nilón, pero llueu fixéronse bien difíciles de consiguir, porque al añu siguiente los Estaos Xuníos entraron na Segunda Guerra Mundial y el nilón foi necesariu pa faer material de guerra, como cuerdes y paracaíes. Pero enantes de les medies o de los paracaíes, el primer productu de nilón foi'l cepiyu de dientes con cerdes de nilón. Les primeres partíes llegaron a Europa en 1945.
Etimoloxía[editar | editar la fonte]
Créese que'l so nome ye un xuegu de pallabres, faciendo referencia a NY (Nueva York) y Lon (Londres), dos ciudaes que conxugaes n'idioma inglés dan como resultáu NyLon, yá que lo afayaríen dos investigadores que vivíen ún en cada ciudá.
Según John W. Eckelberry (DuPont)[ensin referencies], "nyl" ye una sílaba escoyida al azar y "on" ye n'inglés un sufixu de munches fibres.
Otra versión diz que'l nome tendría de ser "non-run", indicando que les medies feches por esti material nun se rompíen con facilidá pero por razones xurídiques camudóse a Nylon.
Otra lleenda atribúi'l nome a abreviaciones de exclamaciones como "Now You Lousy Old Nipponese" (o "Now You Look Old Nippon" o "Now You Loose Old Nippon") en contra de los xaponeses al tratase d'un sustitutu de la seda que s'importara de China ocupada polos xaponeses na Segunda Guerra Mundial.
Propiedaes[editar | editar la fonte]
Mientres la fabricación les fibres de nilón son sometíes a estrusión, testurizáu y filáu en frío hasta algamar cerca de 4 vegaes el so llargor orixinal, lo cual aumenta la so cristalinidá y resistencia a la tracción.
Resistencia[editar | editar la fonte]
| Resistencia Química |----- | Compuestu | Valor | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Alcoholes | ----- | Cetonas | ----- | Grases y Aceites | ----- | Halóxenos | ----- | Hidrocarburos Arumosos | ----- |
La so viscosidá de fundíu ye bien baxa, lo cual puede acarretar dificultaes nel tresformamientu industrial, y la so esposición albentestate puede causar una fraxilización y un cambéu de color sacante si hai estabilización o proteición previa.
Al nilón puede amestáse-y fibra de vidriu p'apurrir una medría na rixidez..
Ye un polímeru cristalín yá que se-y da un tiempu por que se entame y esfrézase amodo, siendo por esto bien resistente.
Les cadenes de nilón con un númberu par d'átomos de carbonu ente los grupos amida son más compactes y los sos puntos de fusión van ser más altos que los nilones con un númberu impar d'átomos de C. El puntu de fusión mengua y la resistencia a l'agua aumenta a midida que aumenta'l númberu de grupos metileno ente los grupos amida.
Puntu de fusión y solubilidá[editar | editar la fonte]
El nilón ye soluble en fenol, cresol y ácidu fórmico. El so puntu de fusión ye de 263 °C.
Mecanismu de reacción[editar | editar la fonte]
El nilón 6,6 tien un monómeru, que se repite n vegaes, cuanto seya necesario pa dar forma a una fibra. El primer 6 qu'acompaña al nilón diznos el númberu de carbonos de l'amida y la segunda cifra ye'l númberu de carbonos de la cadena ácida.
El nilón 6,6 sintetízase por condensación nel llaboratoriu a partir de cloruru d'adipoílu y hexametilenodiamina. Pero nuna planta industrial de nilón, fabrícase xeneralmente faciendo reaccionar l'ácidu adípicu (deriváu del fenol) cola hexametilenodiamina (deriváu del amoniacu).
Cinética[editar | editar la fonte]
Como'l nilón produzse por condensación, la cinética ye por pasos. Por cuenta de qu'hai menos masa nel polímeru que nos monómeros orixinales, dicimos que'l polímeru ta entestáu con al respective de los monómeros. El subproductu ye agua y denómase entestáu.
Les polimerizaciones por condensación xeneren subproductos. Les polimerizaciones por adición, non.
Estructura[editar | editar la fonte]
El nilón 6,6 ye una estructura heteroxénea yá que ta conformáu por C, H, CO, NH.
Estáu[editar | editar la fonte]
Acordies cola funcionalidá F=2, el nilón ye una fibra, xeneralmente d'alta densidá.
La organización de les molécules y l'enfriamientu cuidadosu col que se fai pa esti fin, determina que'l polímeru seya cristalín
Fuercies moleculares[editar | editar la fonte]
Les fuercies moleculares del nilón son secundaries. Presenta fuercies de London (non polar) y múltiples pontes d'hidróxenu, como puede vese na gráfica anterior.
Los enllaces por ponte d'hidróxenu y otres interaiciones secundaries ente cadenes individuales, caltienen fuertemente xuníes a les cadenes polimériques. Tan fuerte, qu'éstes nun pruyen particularmente por esmucise una sobre otra.
Esto significa que cuando s'espurre les fibres de nilón, nun s'estienden enforma, si ye que lo faen. Lo cual esplica por qué les fibres son ideales pa emplegales en filos y lluries.
Les fibres tamién tienen los sos inconvenientes. Magar tienen bona fuercia tensil, ye dicir que son resistentes cuando s'espurre, polo xeneral tienen baxa fuercia compresional, esto ye, son febles cuando s'apreten o s'estrúin. Amás, les fibres tienden a ser resistentes nuna direición, la direición na que tán empobinaes. Si s'espurren n'ángulos reutos a la direición de la so orientación, tienden a debilitase.
Por cuenta d'esta estraña combinación de resistencies y debilidaes, de cutiu resulta una bona idea emplegar les fibres xuntamente con otru material, como un termorríxidu.
Les fibres úsense davezu pa reforzar los termorríxidos. Compensen les falencies de los termorrígidos y al empar, les resistencies de los termorríxidos faen lo propio coles falencias de les fibres.
Cuando un termorríxidu o cualesquier otru polímeru ye reforzáu d'esta miente con una fibra, dizse que ye un material compuestu.
Policondensación y etapes[editar | editar la fonte]
El nilón produzse per aciu de policondensación.
Cuando'l oxíxenu del carbonilu ye protonáu, vuélvese muncho más vulnerable al ataque del nitróxenu de la nuesa diamina. Esto asocede porque l'osíxenu protonáu porta una carga positiva.
Al oxíxenu nun-y presta tener una carga positiva. Entós atrai escontra sigo mesmu los electrones que comparte col carbonilu. Esto dexa al carbonu del carbonilu deficiente d'electrones y llistu por que'l nitróxenu de la amina dóne-y un par.
El dímeru, tamién pue reaicionar con otros dímeros pa formar un tetrámeru. O puede reaicionar con un trímeru pa formar un pentámeru y de la mesma reaicionar con oligómeros más grandes.
Finalmente, cuando esto asocede, los dímeros tresfórmense en trímeros, tetrámeros y oligómeros más grandes y estos oligómeros reaicionen ente sigo pa formar oligómeros entá más grandes. Esto sigue asina hasta que se faen lo suficientemente grandes como pa ser consideraos polímeros
Pa que les molécules crezan lo suficiente como pa ser consideraes polímeros, tenemos que faer esta reaición so vacíu. Nesti casu, tol subproductu agua va evaporase y va ser desaniciáu del mediu de reaición. Tenemos de desfacenos de l'agua por cuenta de una pequeña regla llamada Principiu de Le Châtelier.
Como se dixo enantes, la reaición nun precisa un catalizador ácidu pa llevase a cabu; La razón pola que se sabe esto, ye qu'al averanos a la fin de la polimerización, onde nun hai munchos grupos ácidos remanentes pa portase como catalizadores, la reaición entá prosigue.
Esto ye, l'amina pue reaicionar colos ácidos carboxílicos non protonaos. Si nun fora asina, non podría llograse nilón 6,6 d'altu pesu molecular ensin un catalizador esternu, una y bones la reaición detendríase a conversiones más altes, cuando nun haya abondos grupos ácidos p'actuar como catalizadores. La materia prima pa la producción de nilón 66 ye'l bencenu, que derívase del crackéu y de la reformación del petroleu
Referencies[editar | editar la fonte]
- ↑ Academia de la Llingua Asturiana (2000), «nilón», Uviéu: KRK ediciones, ISBN 84-8168-208-x, http://www.academiadelallingua.com/diccionariu/index.php?pallabra=nil%C3%B3n
- ↑ Academia de la Llingua Asturiana (2000), «nailon», Uviéu: KRK ediciones, ISBN 84-8168-208-x, http://www.academiadelallingua.com/diccionariu/index.php?pallabra=nailon
Enllaces esternos[editar | editar la fonte]
 Wikimedia Commons tien conteníu multimedia tocante a Nilón.
Wikimedia Commons tien conteníu multimedia tocante a Nilón.
